Raksta medicīnas eksperts
Jaunas publikācijas
Cilvēka imūndeficīta vīruss (HIV)
Pēdējā pārskatīšana: 23.04.2024

Visi iLive saturs ir medicīniski pārskatīts vai pārbaudīts, lai nodrošinātu pēc iespējas lielāku faktisko precizitāti.
Mums ir stingras iegādes vadlīnijas un tikai saikne ar cienījamiem mediju portāliem, akadēmiskām pētniecības iestādēm un, ja vien iespējams, medicīniski salīdzinošiem pārskatiem. Ņemiet vērā, ka iekavās ([1], [2] uc) esošie numuri ir klikšķi uz šīm studijām.
Ja uzskatāt, ka kāds no mūsu saturiem ir neprecīzs, novecojis vai citādi apšaubāms, lūdzu, atlasiet to un nospiediet Ctrl + Enter.
Iegūtā imūndeficīta sindroms tika identificēts kā konkrētu slimību 1981. Gadā ASV, kur vairāki jaunieši būt nopietnas slimības, ko izraisa mikroorganismi, nepatogēnām vai zemu patogēns veseliem indivīdiem. Pacientu imunitātes stāvokļa pētījumā atklājās straujš limfocītu skaita samazinājums vispār un īpaši T-palīdzības sniedzējiem. Šo stāvokli sauc par AIDS (angļu valodas iegūtais imūndeficīta sindroms - iegūtais imūndeficīta sindroms vai AIDS). Infekcija metode (seksuāla kontakts, caur asinīm un asins produktiem), kas norādīts uz infekciozo raksturu slimības.
Izraisītājvielas AIDS tika atklāts 1983. Neatkarīgi francūzis L. Montagnier, kurš to nosauca LAV Lymphoadenopathy Associated Virus), jo tas tika atrasts pacientu limfadenopātiju; un amerikāņu R. Gallo, kurš nosauca vīrusu HTLV-III (angļu Cilvēka T-limfotropo Virus III - T-limfotropo vīruss Cilvēka III.): pirms tie tika atklāti limfotropo vīrusi I un II.
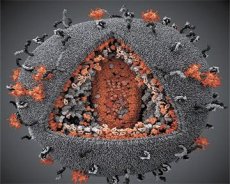
LAV un HTLV-III vīrusu īpašību salīdzinājums parāda to identitāti, tādēļ 1986. Gadā vīruss tika saukts par HIV (cilvēka imūndeficīta vīrusu vai HIV), lai izvairītos no pārpratumiem. HIV ir sfēriska, tā diametrs ir 110 nm. Vīrusa aploks ir polietiņra formā, kas sastāv no 12 pentagoniem un 20 sešstūriem. Glikozilētā proteīna gpl20 molekula atrodas katra sešstūra centrā un stūrī (numurs 120 nozīmē proteīna molekulmasu kilodaltonos). Viriona virsmā atrodas kopumā 72 gPL20 molekulas, no kurām katra ir saistīta ar intramembranā olbaltumvielu gp41. Šīs olbaltumvielas kopā ar dubulta lipīdu slāni veido viriona supercapsid (membrānu).
Olbaltumvielas gpl20 un gp41 veidojas no prekursoru proteīna Env šūnu proteāzes izciršanas rezultāta. Olbaltumviela gp41 veido mugurkaula "knaibles", kuru citoplazmatiskais lauks ir saistīts ar matricas proteīnu p17MA tieši zem membrānas. Molekulas p17, kas mijiedarbojas ar viriona nobriešanu, veido čaumalas pamatā esošu icosahedronu.
Viriona centrālajā daļā p24 proteīns veido konisku kapsīdu. Kapsīda sašaurinātā daļa, iesaistot pb proteīnu, ir saistīta ar viriona aploksni. Kapsīda iekšienē ir divas identiskas vīrusa genomiskās RNS molekulas. Tās ir saistītas ar to 5 'galiem ar nukleokapsīdu proteīnu p7NC. Šis proteīns ir interesants ar to, ka tam ir divi aminoskābju atlikumus (motīvs), cisteīna bagāti un histidīns atoms un kas satur Zn, - tos sauc par "cinks pirksts", jo tie uztveršanas molekulas genoma RNS iemontēšanai virionu veidojas. Kapsīds satur arī trīs enzīmus. Reversas (RT) vai pol-komplekss ietver reverso transkriptāzi, RNS-ase H un no DNS atkarīgu DNS polimerāzi. Revertācija ir kā p66 / p51 heterodimērs. Proteāzes (PR) - pI, sāk un realizē viriona nobriešanas procesu. Integrācija (IN) - p31 vai endonukleāze nodrošina provirālās DNS iekļaušanu saimniekorganisma šūnas genomā. Kapsīds satur arī sēklas RNS molekulu (tRNAl "3).
RNS gēns šūnā tiek pārvērsts ar reverso transkriptāzi DNS genomā (DNS provīrā), kas sastāv no 9283 nukleotīdu pāriem. Tas ir ierobežots kreisajā un labajā pusē ar tā dēvēto garo end atkārtojumu vai LTR (angļu garais termināla atkārtojums): S'-LTR - pa kreisi un Z'-LTR - pa labi. LTR satur 638 nukleotīdu poras.
HIV genomam ir 9 gēni, no kuriem daži ir pārklāti (ir vairāki lasīšanas ietvari), un tam ir eksonīna struktūra. Viņi kontrolē 9 strukturālo un 6 regulējošo proteīnu sintēzi.
Vīrusu genoma LTR vērtība ir tāda, ka tajos ir šādi regulējoši elementi, kas kontrolē tā darbību:
- transkripcijas signāls (promotora reģions);
- signāls poli-A pievienošanai;
- Uztveršanas signāls;
- signāla integrācija;
- pozitīvs regulējošais signāls (TAT proteīna TAR);
- negatīvās regulēšanas elements (NEF proteīna NRE);
- sēklu RNS piestiprināšanas vieta (tRNA ™ 3) DNS mīnus ķēdes sintēzei 3 'beigās; signāls LTR 5'-galā, kas kalpo kā grunts DNS plus virknes sintēzei.
Bez tam, LTR satur elementus, kas saistīti ar mRNS mijiedarbības regulēšanu, iepakojot vRNS molekulas kapsīdā (Psi elements). Visbeidzot, transkribējot genomu garās mRNS, tiek ģenerēti divi signāli REV proteīnam, kas pārslēdz proteīnu sintēzi: regulējošo olbaltumvielu CAR un strukturālo proteīnu DRS. Ja REV proteīns saistās ar CAR, tiek strukturēti olbaltumvielas; ja tā nav, tiek sintezēti tikai regulējošie proteīni.
Vīrusa genoma regulēšanā īpaši svarīga loma ir šādiem regulējošiem gēniem un to olbaltumvielām:
- TAT proteīns, kas pozitīvi kontrolē vīrusa reprodukciju un darbojas ar regulējošas TAR vietnes palīdzību;
- proteīni NEV un VPU, kas negatīvi kontrolē reprodukciju caur NRE vietni;
- proteīns REV, veicot pozitīvu negatīvu kontroli. Proteīns REV kontrolē gēnu gag, pol, env darbību un veic negatīvo regulējumu splicing.
Tādējādi HIV reprodukcija ir trīskārša kontrole - pozitīva, negatīva un pozitīva-negatīva.
VIF proteīns nosaka nesen sintezētā vīrusa inficētspēju. Tas ir saistīts ar kapīdu proteīnu p24 un ir viriona daudzums 60 molekulās. NEF proteīns virionā ir attēlots ar nelielu skaitu molekulu (5-10), kas, iespējams, ir savienota ar aploksni.
VPR proteīns inhibē šūnu cikla pie G2 fāzē, kas iesaistīts transporta preintegratsionnyh kompleksiem šūnas kodola un aktivizē noteiktas vīrusu un šūnu gēnus, palielina efektivitāti vīrusa replikāciju monocītu un makrofāgu. Proteīnu atrašanās vieta VPR, TAT, REV, VPU virionā nav noteikta.
Papildus savām olbaltumvielām viriona membrānas sastāvā var būt arī daži no saimniekorganisma šūnu proteīniem. Proteīni VPU un VPR ir iesaistīti vīrusa reprodukcijas regulēšanā.
Cilvēka imūndeficīta vīrusa antigēna varianti (HIV)
Cilvēka imūndeficīta vīruss (HIV) ir ļoti mainīgs. Pat no viena pacienta organisma var izolēt vīrusa celmus, kas būtiski atšķiras antigēnu īpašībās. Šādu mainīgumu veicina CD4 + šūnu intensīva iznīcināšana un spēcīga antivielu atbilde uz HIV infekciju. Pacientiem no Rietumāfrikas ir jauna HIV forma, kas ir bioloģiski tuvu HIV-1, bet ir imunoloģiski atšķirīga no tā, HIV-2. Šo vīrusu genomu primārās struktūras homoloģija ir 42%. DNS proviruss HIV-2 satur 9671 bp un tā LTR - 854 bp. Vēlāk HIV-2 tika izolēts citos pasaules reģionos. Starp HIV-1 un HIV-2 nav savstarpējas imunitātes. Ir zināmi divi lieli HIV-1 veidi: O (Outlier) un M (Major), pēdējie ir iedalīti 10 apakštipā (AJ). Krievijā cirkulē 8 apakštipi (AH).
HIV mijiedarbības mehānisms ar šūnu
Kad tā ir iekļāvusies ķermenī, vīruss vispirms uzbrūk šūnām, kas satur noteiktu CD4 receptoru. Šajā receptorā ir liels skaits T palīdzības līdzekļu, mazāk - makrofāgi un monocīti, īpaši pret vīrusiem jutīgi T-palīgi.
Cilvēka imūndeficīta vīruss (HIV) atzīst CD4 receptorus ar gpl20 proteīnu. HIV mijiedarbības process ar šūnu notiek saskaņā ar sekojošo shēmu: ar receptoru saistītā adsorbcija -> robežas fovea -> robežojas ar pūslīšu -> lizosomu. Tajā viriona membrāna saplūst ar lizosomu membrānu, un nukleokapsīds, atbrīvots no supercapidīta, nonāk citoplazmā; ceļā uz kodolu tas tiek iznīcināts, un tiek atbrīvota genoma RNS un saistītās galvenās sastāvdaļas. Next, apgrieztās transkriptāzes synthesizes uz virionu RNS-mīnus DNS praimera pavedienu, kam seko ribonukleāzes H sagrauj viriona RNS un vīrusa DNS polimerāze sintezē DNS plus ķēdi. DNS provirusa galos veido 5'-LTR un 3'-LTR. DNS provīrus kādu laiku var būt neaktīvā formā kodolā, bet agrāk vai vēlāk ar integrāzes palīdzību tas integrējas mērķa šūnas hromosomā. Tajā provīrs atrodas neaktīvā stāvoklī, līdz šo T-limfocītu aktivē mikrobu antigēni vai citas imūnkompetentās šūnas. Šūnu DNS transkripcijas aktivizēšanu regulē īpašs kodolenerģijas faktors (NF-kB). Tas ir DNS saistošais olbaltumvielas un lielā daudzumā tiek iegūts T-limfocītu un monocītu aktivācijas un proliferācijas laikā. Šis proteīns saistās ar specifiskām LTR DNS provirusa šūnu DNS un līdzīgām sekvencēm un inducē gan šūnu DNS, gan DNS provirusa transkripciju. Veicinot DNS provirusa transkripciju, viņš pārnes vīrusu no neaktīvā stāvokļa uz aktīvo un attiecīgi noturīgo infekciju produktīvā vidē. Palikšana provīrā neaktīvā stāvoklī var ilgt ļoti ilgu laiku. Vīrusa aktivizēšana ir kritisks moments mijiedarbībā ar šūnu.
No brīža, kad vīruss nonāk šūnā, sākas HIV infekcijas periods , vīruss, kas var ilgt 10 gadus vai ilgāk; un kopš vīrusa aktivizēšanas sākas slimība - AIDS. Ar savu regulējošo gēnu un to produktu palīdzību vīruss sāk aktīvi vairoties. TAT proteīns var palielināt vīrusa reproduktīvo ātrumu 1000 reizes. Vīrusu transkripcija ir sarežģīta. Tas ietver gan pilna garuma, gan subgenomisko mRNA veidošanos, mRNS salīmēšanu un strukturālu un regulējošu proteīnu turpmāku sintēzi.
Konstruktīvo proteīnu sintēze notiek šādi. Pirmkārt, sintezēts poliproteīnu prekursors Pr55Gag (proteīns ar masu 55 kD). Tā satur četras galvenās domēnus: a matrix (MA), capsid (CA), nukleokapsīdu (NC) un domēna pe, no kura rezultātā griešanas Pr55Gag vīrusu proteāzes (IT samovyrezaetsya no cita proteīna prekursora - Gag-Pol) ir izveidoti attiecīgi nestrukturālu proteīnu p17 , p24, p7 un pb. Poliproteīna Pr55Gag veidošanās ir galvenais nosacījums vīrusu daļiņu veidošanai. Tas ir šis proteīns, kas nosaka viriona morfogenezēšanas programmu. Tā ietver soļus secīgi gag poliproteīna transportēšanu uz plazmas membrānu un tā mijiedarbību ar proteīnu-proteīnu mijiedarbības veidošanās vīrusu daļiņu un tās budding. Pr55Gag tiek sintezēts uz brīvām polibriomas; olbaltumvielu molekulas tiek transportētas uz membrānu, uz kuras tās piestiprina ar hidrofobiskiem plāksteriem. Galvenā loma, veidojot vietējo Gag proteīna konformāciju, ir CA domēns. NC-domēns slēdzis nodrošina (ko panāk ar "cinka pirkstiem") 2 molekulā genoma RNS iekļaušanu vīrusu daļiņu veidošanos. Poliproteināla molekula vispirms tiek dimerizēta matricas domēnu mijiedarbības dēļ. Tad dimēru apvienotas hexameric (6 units) kompleksus, mijiedarbību domēni CA un NC. Visbeidzot, hexamers, kas savieno sānu virsmām veido nenobriedušus virionu sfēriska forma, iekšpusē, kas satur vīrusa genoma RNS uzņemto NC-domēnu.
Vēl viens prekursora proteīna Prl60Gag-Pol (olbaltumvielas ar m. M. 160 kDa) ir sintezēts kā rezultātā novirzot lasīšanas rāmi ribosomas translation Z'-gala gag gēna laikā ir izveidojies tieši pirms kodēšanas reģions RB proteīnu. Šis Gag-Pol poliproteīns satur nepilnīgu Gag olbaltumvielu secību (1-423 aminoskābes) un Pol sekvences, kas ietver PR, RT un IN domēnus. Poliproteīna Gag-Pol molekulas tiek sintezētas arī uz bezmaksas polibriomas un tiek transportētas uz plazmas membrānu. Poliproteīns Prl60Gagpol satur visas starpmolekulāro mijiedarbību vietas, kas raksturīgas poli-proteīnu Gag un membrānas saistīšanās vietām. Tāpēc molekulas poliproteīna Gag-Pol drošinātāju ar membrānas, un kopā ar Gag-molekulas ietver veido virionu, kas varētu izraisīt aktīvs proteāzes un virion nogatavināšanas process sākas. HIV-1 proteāze ir ļoti aktīva tikai dimēra formā, tādēļ, lai tās paši izceltu no Prl60Gag-Pol, ir nepieciešama šo molekulu dimerizācija. Viriona nogatavošanās ir tāda, ka atbrīvotie aktīvās proteāzes izcirtņi prl60Gag-Pol un Gag55 atpazīstamās vietās; proteīni p17, p24, p7, p6, revertāze, integrāze un to saistība ar vīrusu struktūru notiek.
Env proteīns tiek sintezēts uz ribosomas, kas saistītas ar membrānu endoplazmiskajā retikulā, glikozilēts un pēc tam tas tiek sagriezts šūnu proteāzes uz gp120 un gp41 un tiek transportēts uz šūnu virsmas. Šajā gadījumā gp41 caurlaidina membrānu un saistās ar Gag proteīna molekulas matrices jomām, kas saistītas ar membrānas iekšējo virsmu. Šīs attiecības saglabājas nobriedušajā virionā.
Tādējādi, montāža no vīrusu daļiņu ir agregācija prekursoru proteīnu un ar to saistīto RNS molekulu uz plazmas membrānu saimniekorganisma šūnas, veidojot neattīstītas virionu un to atbrīvošanu pēc budding no šūnas virsmas. Kad topošais virion ieskauj sevi ar šūnu membrānu, kas ir uzcelta gp41 un gp120 molekulas. Laikā budding vai, iespējams, pēc atbrīvošanas no virionu nobriešanas notiek, kas tiek veikta, izmantojot vīrusu proteāze ir neproteolītiski griešanas Pr55Gag prekursoru proteīnus un Prl60Gag-Pol vīrusu nobriešanai proteīnus un to saistībai ar specifisko strukturālo kompleksu. Vadošais loma morfoģenēzes vīrusa spēlē poliproteīna priekšteci Pr55Gag, kas organizē un saliek nenobriedušu virion; To nogatavināšanas procesu pabeidz īpaša vīrusa proteāze.
Imūndeficīta cēloņi
Viens no galvenajiem HIV infekcijas imūndeficīta cēloņiem ir T-palīdzības personu masveida nāve. Tas notiek šādu notikumu dēļ. Pirmkārt, T-helper vīrusi, kas inficēti ar vīrusu, mirst sakarā ar apoptozi. Tiek uzskatīts, ka pacientiem ar AIDS vīrusu replikācijas, apoptozes un skaita samazināšanos par T-palīgs šūnas ir savstarpēji. Otrkārt, T-killer šūnas atpazīst un iznīcināt elgn inficēti ar vīrusu vai uz kura ir adsorbēts gpl20 molekulas, kā arī vīrusu inficētās un vīrusu inficētās T-helperu šūnu, kas veido symplasts (syncytia), kas sastāv no vairākiem desmitiem no šūnām (daļa no kompleksa viņi mirst virknu pavairošanas rezultātā). Sakarā ar iznīcināšanu liels skaits T-helperu šūnu notiek samazinājums membrāna receptora izpausmi B limfocītu ar IL-2, traucēta sintēze no dažādiem interleikīnu (augšanas faktoriem un diferenciācijas B-limfocītu -. IL-4, IL-5, IL-6, un citi) kā rezultātā tiek pārkāpta T-killer sistēmas funkcija. Samazina komplementa un makrofāgu sistēmu aktivitāti. Vīrusu inficēti makrofāgi un monocītu ilgi mirt, bet tie nespēj noņemt vīrusu no organisma. Visbeidzot, sakarā ar strukturālo un antigēnu līdzību ar receptoriem gpl20 dažas epitēlija šūnas no organisma (ieskaitot trophoblasts receptors starpnieka HIV pārnešanas transplantācijas) tiek sintezēts antiretseptornyh antivielas ar plaša spektra darbības. Šādas antivielas var bloķēt dažādus šūnu receptorus un komplicēt slimības gaitu ar autoimūniem traucējumiem. HIV infekcijas sekas ir visu lielāko imūnsistēmas daļu pārvarēšana. Šādi pacienti kļūst neaizsargāti pret daudziem mikroorganismiem. Tas izraisa oportūnistisku infekciju un neoplastisku slimību attīstību. Pacientiem ar HIV infekciju ir bijuši paaugstināts risks vismaz trim vēža veidiem: Kapoši sarkoma; karcinomas (arī ādas vēzis); B-šūnu limfoma, kas rodas B limfocītu ļaundabīgās deģenerācijas rezultātā. Tomēr HIV ir ne tikai limfocītu, bet arī neirotropisks. Tas iekļūst CNS šūnās (astrocytes) vai nu ar receptoru mediētu endocitoze un fagocitozes no astrocytes ar vīrusu inficētās limfoblastu. Mijiedarbībā ar vīrusu ar astrocytes tiek veidota arī symplasts kas sekmē patogēna izplatīšanos starpšūnu kanāliem. Makrofāgos un monocītu, vīruss var saglabāties ilgu laiku, lai tie kalpotu kā rezervuārs un tās izplatītājiem organismā, ir iespēja iekļūt visos audos. Inficētiem makrofāgiem ir liela nozīme HIV migrācijā centrālajā nervu sistēmā un tās sakāvē. 10% no pacientiem ar primārajiem klīniskie sindromi, kas saistītas ar CNS un parādīti formā demences (demences). Tādējādi cilvēkiem, kurus skārusi HIV infekcija, pastāv 3 slimību grupas - oportūnistiskas infekcijas, audzēju slimības un centrālās nervu sistēmas traucējumi.
HIV infekcijas epidemioloģija
HIV infekcijas avots ir tikai cilvēks - slimības vai vīrusa nesējs. Cilvēka imūndeficīta vīruss (HIV) ir atrodams asinīs, spermā, dzemdes kakla vēderā; barojušās mātes - mātes pienā. Infekcija rodas seksuāli, caur asinīm un tās zālēm, kā arī no mātes bērnam pirms dzemdībām, dzemdību laikā un pēcdzemdību periodā. Nav zināmi gadījumi, kad vīruss inficējas ar pārtiku, dzērieniem un kukaiņu kodumiem.
Narkoloģiskā atkarība veicina AIDS izplatīšanos. HIV infekcija katru gadu pieaug. Pēc PVO datiem, no 1980. Līdz 2000. Gadam 58 miljoni cilvēku bija inficēti ar HIV. Tikai 2000. Gadā pasaulē tika inficēti 5,3 miljoni cilvēku, bet AIDS izraisīja 3 miljoni cilvēku. Krievijā no 2004. Gada 1. Janvāra reģistrēti 264 000 HIV pozitīvu cilvēku. Puse no HIV inficētajiem vīriešiem mirst 11-12 gadu laikā pēc infekcijas. 2004. Gada sākumā no katriem 100 000 krievu pilsoņiem aptuveni 180 dzīvoja ar HIV infekcijas diagnozi. Paredzams, ka šajā saslimstības līmenī kopējais HIV inficēto cilvēku skaits Krievijā līdz 2012. Gadam būs 2,5-3 miljoni cilvēku. Cīņas pret HIV infekciju sarežģītība ir atkarīga no vairākiem iemesliem: pirmkārt, nav efektīvu ārstēšanas metožu un specifiskas profilakses; Otrkārt, HIV infekcijas inkubācijas periods var pārsniegt 10 gadus. Tās ilgums ir atkarīgs no T-limfocīta un DNS-provīrusa aktivācijas brīža, kas atrodas tās hromosomā. Vēl nav skaidrs, vai katrs vīruss, kas inficēts ar AIDS, ir nolemts vai tam, iespējams, ir ilgstošs vīruss bez slimības (kas šķiet maz ticams). Visbeidzot, ir vairāki cilvēka imūndeficīta vīrusi (HIV-1, HIV-2), antigēnu atšķirības, starp kurām novērš krusteniskas imunitātes veidošanos. Pērtiķu imūndeficīta vīrusa (SIV) noteikšana atklāj HIV izcelsmi. SIO genoma organizēšanai ir līdzīgs HIV, taču tas ievērojami atšķiras nukleotīdu secībā. HIV-2 seroloģiski ieņem starpposmu starp HIV-1 un SIV, un nukleotīdu sekvence ir tuvāk SIV. Šajā sakarā VM Zhdanovs ierosināja, ka vīrusi HIV-1, HIV-2 un SIV ir iegūti no kopējā sencara. Saskaņā ar R. Gallo teikto iespējams, ka viens no SIV kaut kādā veidā nonāk cilvēka ķermenī, kur viņam tika veiktas vairākas mutācijas, kā rezultātā HIV-1, HIV-2 un citas tā formas.
HIV infekcijas simptomi
Cilvēka imūndeficīta vīrusam raksturīgas noteiktas īpašības, no kurām lielā mērā slimības patogeneze ir atkarīga. Vīruss ir ļoti augsts reproduktīvais daudzums, ko nosaka tā regulējošie elementi (aktīvajā stadijā 5 minūšu laikā sintezē 5000 virjonu). Sintētiskā proteīna (gp41) klātbūtnes dēļ vīruss izraisa plašu sincitālu struktūru veidošanos, pateicoties inficēto un neinficēto T-helperu saplūšanai, kā rezultātā to masveida nāve. Liela molekula gpl20 molekulas brīvi cirkulē asinīs un saistās ar neinficētu T-palīgu receptoriem, kā rezultātā tos atzīst un iznīcina T-killers. Vīruss var izplatīties caur šūnu starp šūnu šūnām uz šūnu, šajā gadījumā tas kļūst vieglāk pieejams antivielām.
HIV infekcijas klīniskie kritēriji
Pieaugušo HIV noteikt, ja tie ir vismaz divi nopietni simptomi kombinācijā ar vismaz vienu simptoms nepilngadīgs, ja nav citu zināmu iemeslu imūndeficīta (vēzi, iedzimtu imūndeficītu, smaga bada un P. Tā tālāk.). Nopietni simptomi ir:
- svara zudums par 10% vai vairāk;
- ilgstošs drudzis, pārtraukts vai ilgstošs;
- hroniska caureja.
Minor simptomi ir pastāvīgs klepus, ģeneralizētas dermatīts, periodiskās herpes zoster, kandidozes mutes dobuma un rīkles gala, hronisks herpes simplex, ģeneralizēta limfadenopātija. AIDS diagnoze tiek veikta tikai ar Kapoši sarkomu, kriptokoku meningītu, pneimocista pneimoniju. Slimības klīnisko ainu ietekmē oportūnistiska infekcija.
Cilvēka imūndeficīta vīrusa (HIV) audzēšanas metodes
HIV-1 un HIV-2 var kultivēt tikai viena TCB4-limfocītu klona - H9, kas iegūti no leikozes TCV4-limfocītiem. Tajā pašā nolūkā var izmantot arī astrozītu šūnu vienkrāsas kultūras, kurās HIV-1 reizina labi. No dzīvniekiem līdz HIV-1 jutīgām šimpanzēm.
Vīrusa izturība ārējā vidē ir zema. Viņš mirst saules staru un UV starojuma ietekmē, tiek iznīcināts 80 ° C temperatūrā 30 minūtes, to apstrādājot ar parasti lietotiem dezinfekcijas līdzekļiem - 20-30 minūtes. Lai vīrusu saturošus materiālus dezinficētu, ir jāizmanto mikobaktericīdie dezinfekcijas līdzekļi, jo tie ir efektīvi pret mikroorganismiem ar visaugstāko pretestību.
HIV infekcijas laboratorijas diagnoze
Galvenais vīrusu un HIV infekcijas diagnostikas veids ir enzīmu imūnanalīze. Tomēr, sakarā ar to, ka gpl20 ir strukturāli un antigēnu līdzība ar receptoriem dažu cilvēka šūnām, tai skaitā receptoriem, kas veic transportēšanu imūnglobulīnu caur epitēlija šūnas gļotādu organismā var parādīties antivielas, kas saistītas antivielas pret gpl20. Šajā gadījumā IFM var būt nepareizi pozitīvi rezultāti. Tādēļ visi visi pozitīvi reaģējošie pētāmie serumi tiek pakļauti papildu analīzei, izmantojot imūnblota metodi vai Western blotting. Šī metode pamatojas uz to antivielu identifikāciju, kuras jāpārbauda pēc elektroforēzes atdalīšanas un pēc tam ar marķētām pretvīrusu antivielām. Viroloģiskā metode ir maz lietderīga, jo vīrusa kultūras sarežģītība. H9 limfocītu klonu izmanto vīrusu antigēnu iegūšanai - diagnostikas testēšanas sistēmu vajadzīgās sastāvdaļas. CDR metode ļauj konstatēt vīrusu jau agrīnā viremijas stadijā.
HIV infekcijas ārstēšana
Ir nepieciešams atrast vai sintezēt zāles, kas efektīvi inhibē reversās transkriptāzes (revertāzes) vai vīrusu proteāzes aktivitāti. Tās novērš DNS proviru veidošanos un (vai) kavē vīrusa interselulāro pavairošanu. Modern stratēģija ārstēšanai HIV inficētiem pacientiem ir balstīta uz kombinētā narkotiku lietošanu, kas inhibē vīrusa proteāzes (viena no zāles) un revergazu (2 dažādas narkotiku) principa, - kombinētā (triple) terapiju. Krievijā, lai ārstētu HIV inficēti cilvēki ieteica kombinēto izmantošanu divu vietējo narkotiku: CRIXIVAN Phosphazide un īpaši kavē reprodukcija HIV sākumā un vēlīnā audzēšanu, jo īpaši ar samazinātu aktivitāti AZT.
Specifiskas profilakses problēma ir nepieciešamība izveidot vakcīnu, kas nodrošinātu efektīva šūnu imūnās sistēmas veidošanos, pamatojoties uz vīrusiem raksturīgiem citotoksiskiem limfocītiem, bez ievērojamas antivielu radīšanas. Šādu imunitāti nodrošina Thl-palīgi. Iespējams, ka antivielas, arī vīrusu neitralizējošās, ir ne tikai neefektīvas, lai nomāktu HIV infekciju, bet augstā līmenī viņi nomāc šūnu mediēto imunitāti. Tāpēc anti-HIV vakcīnai galvenokārt jāatbilst divām pamatprasībām: a) jābūt pilnīgi drošām un b) stimulēt T-citotoksisko limfocītu darbību. Tiek pētīta dažādu vakcīnu variantu efektivitāte, kas iegūti no nogalinātajiem (inaktivētiem) vīrusiem un no atsevišķiem antigēniem ar augstu aizsargājošo īpašību. Šādus antigēnus var vai nu izolēt no pašiem virioniem, vai ķīmiski sintezēt. Ir ierosināta vakcīna, kas balstīta uz gēnu inženierijas metodēm. Tas ir rekombinanto vakcinācijas vīruss, kas satur HIV gēnus, kuri ir atbildīgi par antigēnu sintēzi ar spēcīgām imunogēnām īpašībām. Lēmums par šo vakcīnu efektivitāti prasa daudz laika HIV infekcijas inkubācijas perioda ilguma un patogēna lielā mainīguma dēļ. Radīt ļoti efektīvu vakcīnu pret HIV ir steidzama fundamentāla problēma.


 [
[