Raksta medicīnas eksperts
Jaunas publikācijas
Prostatas vēža stadiju diagnostika
Pēdējā pārskatīšana: 04.07.2025

Visi iLive saturs ir medicīniski pārskatīts vai pārbaudīts, lai nodrošinātu pēc iespējas lielāku faktisko precizitāti.
Mums ir stingras iegādes vadlīnijas un tikai saikne ar cienījamiem mediju portāliem, akadēmiskām pētniecības iestādēm un, ja vien iespējams, medicīniski salīdzinošiem pārskatiem. Ņemiet vērā, ka iekavās ([1], [2] uc) esošie numuri ir klikšķi uz šīm studijām.
Ja uzskatāt, ka kāds no mūsu saturiem ir neprecīzs, novecojis vai citādi apšaubāms, lūdzu, atlasiet to un nospiediet Ctrl + Enter.
Klīniski izšķir lokalizētu (T1-2 , N0 , M0 ), lokāli progresējošu (T3-4 , N0-1 , M0 ) un ģeneralizētu vēzi (T1-4 , N0-1 , M1 ).
Pacienti ar klīniski lokalizētām un lokāli progresējošām stadijām tiek klasificēti pēc riska pakāpes (D'Amico A V. et al., 2003):
- zems: T1a -c stadija; PSA līmenis mazāks par 10 ig/ml: Glīsona pakāpe - 2-5; biopsijā - vienpusējs bojājums mazāks par 50%:
- mērena: T2a stadija; PSA līmenis mazāks par 10 ng/ml; Glīsona skala - 3 + 4 = 7; biopsijā - divpusējs bojājums mazāks par 50%;
- augsta stadija T2b , T3a -b; PSA līmenis - 10-20 ng/ml; Glīsona pakāpe - vairāk nekā 4 + 3 - 7; biopsijā - bojājumi vairāk nekā 50%, perineurāla invāzija;
- ļoti augsta: T4 stadija; PSA līmenis virs 20 ng/ml; Glīsona skalas vērtējums virs 8; biopsija uzrāda limfovaskulāru invāziju.
Pēc diagnozes precizēšanas un procesa izplatības noteikšanas (lokalizēts, lokāli progresējošs vai ģeneralizēts) ārsts un pacients nonāk ārstēšanas metodes izvēles priekšā. Mūsdienu sabiedrībā liela nozīme tiek piešķirta pacientu dzīves kvalitātei pēc ārstēšanas uzsākšanas. Dzīves kvalitāte bez ārstēšanas atbilst pamatslimības gaitai un ir atkarīga no onkoloģiskā procesa progresēšanas. Dzīves kvalitātes izmaiņas galvenokārt notiek pēc ārstēšanas uzsākšanas un kādas no terapeitiskajām vai ķirurģiskajām metodēm izmantošanas. Skaidra procesa stadijas noteikšana ļauj ne tikai izvēlēties optimālo ārstēšanas metodi, bet arī prognozēt turpmāko slimības gaitu.
PSA līmeņa noteikšana kombinācijā ar prostatas vēža klīnisko ainu un audzēja gradāciju pēc Glīsona skalas ievērojami palielina katra no uzskaitītajiem rādītājiem informatīvo saturu vēža patoloģiskās stadijas noteikšanā. AV Partins un līdzautori (1997) ierosināja prognostiskās tabulas, kas ļauj prognozēt audzēja tālāku izplatību, ārstēšanas metodes izvēli, radikalitātes pakāpi un ārstēšanas efektivitātes prognozi.
Lai novērtētu audzēja izplatību, visbiežāk izmantotās metodes ir DRE, TRUS, PSA līmeņa noteikšana un kaulu scintigrāfija. Ja nepieciešams, tiek nozīmēta datortomogrāfija (DT) vai magnētiskās rezonanses attēlveidošana (MRI) un krūškurvja rentgenogrāfija.
Jebkura no attēldiagnostikas metodēm ir paredzēta, lai noteiktu stadiju un novērtētu ārstēšanas efektivitāti. Pēc diagnozes pārbaudes urologam jāprecizē primārā audzēja apjoms, tā robežas, audzēja invazīvais vai metastātiskais potenciāls. Visiem šiem rādītājiem ir liela nozīme slimības prognozē un ārstēšanas metodes izvēlē.
Primārais audzējs (T)
Pirmkārt, jānosaka, vai audzējs aprobežojas ar prostatas dziedzeri (T 1-2 ) vai sniedzas ārpus kapsulas robežām (T 3-4 ). Digitālā izmeklēšana bieži vien neļauj novērtēt audzēja izplatību. Saskaņā ar dažiem datiem, DRE rezultāti atbilst histoloģiskās izmeklēšanas rezultātiem mazāk nekā 50% pacientu. Tomēr detalizētāka izmeklēšana ir indicēta tikai tad, ja tiek lemts par radikālu ārstēšanu.
PSA līmenis var atspoguļot audzēja izplatību, taču tas neļauj precīzi noteikt morfoloģisko stadiju. PSA līmeņa, Glīsona indeksa un palpācijas datu kombinācija ļauj labāk prognozēt morfoloģisko stadiju nekā katrs no šiem parametriem atsevišķi. Brīvā PSA vērtība ir pretrunīga: vienā pētījumā brīvā PSA satura noteikšana palīdzēja precizēt stadiju lokalizētos audzējos, taču citi pētījumi to neapstiprināja. Tikai padziļināti pētījumi palīdzēs atrisināt šo jautājumu.
Visbiežāk prostatas dziedzera stāvokļa izmeklēšanai izmanto transrektālo ultraskaņu. Šī metode var atklāt tikai 60% audzēju un ne vienmēr parāda kapsulas invāziju. Gandrīz 60% pacientu ar T3 stadiju . Ultraskaņa norāda uz retāk sastopamu procesu. Kapsulas invāzijas ultraskaņas pazīmes ir dziedzera kontūras izspiedums, nelīdzenums un plīsums. Audzēja šūnu invāzija sēklas pūslīšos ir slikta prognostiska pazīme, taču informācija par to ir ārkārtīgi svarīga ārstēšanas metodes izvēlei. Veicot TRUS, uzmanība jāpievērš pūslīšu ehostruktūrai (hiperehogenitātei), to asimetrijai, deformācijai un paplašināšanai. Arī sēklas pūslīšu bojājumus norāda apaļuma zudums un sablīvēšanās dziedzera pamatnē. Šīs pazīmes ir diezgan subjektīvas, tāpēc pilnībā paļauties uz ultraskaņas datiem nav pareizi. Sēklas pūslīšu invāzija norāda uz augstu lokālas recidīva un metastāžu risku, un to biopsija ir indicēta precizēšanai (pirms operācijas). Izmeklēšanu nevajadzētu sākt ar šo procedūru, bet, ja invāzijas risks ir augsts un ārstēšanas izvēle ir atkarīga no biopsijas rezultāta, tad tās ieviešana ir pamatota. Negatīvs rezultāts neizslēdz mikroskopisku invāziju. Parasti sēklas pūslīšu biopsija tiek veikta klīniskajā stadijā T2b un augstākā, un PSA saturs ir lielāks par 10 ng/ml. Rezultāts tiek uzskatīts par pozitīvu, ja vismaz vienā biopsijā no prostatas dziedzera pamatnes ir audzēja šūnas. Ne tikai papildu pētījumi, bet arī rūpīga primārās biopsijas rezultātu analīze ļauj palielināt stadijas klīniskās noteikšanas precizitāti (lomu spēlē audzēja perēkļu skaits un apjoms, kapsulas invāzija). Svarīga ir arī diferenciācijas pakāpe: ar Glīsona indeksu, kas mazāks par 6, audzējs ir lokalizēts 70% gadījumu.
Asins plūsma prostatas dziedzerī vēža gadījumā ir lielāka nekā normālā dziedzerī vai ar tā hiperplāziju. Pēc kastrācijas asins plūsmas intensitāte dziedzerī samazinās. Daudzsološa ir ehodoplerogrāfisko karšu izstrāde prostatas vēža diagnostikai un uzraudzībai, taču pašlaik nav ticamu datu par ehodoplerogrāfijas izmantošanu lokālā procesa stadijas noteikšanā. Ar šo metodi ir iespējams iegūt papildu materiālu mērķtiecīgas biopsijas laikā no patoloģiskas vaskularizācijas perēkļiem.
Prostatas vēža vizualizācijas rezultāti tieši atkarīgi no klīnikas tehniskā aprīkojuma un speciālista pieredzes. Tāpēc visām mūsdienu vizualizācijas metodēm nav noteicoša, bet gan precizējoša loma, un ārstēšanas metodes izvēle balstās uz klīniskās izmeklēšanas datu un instrumentālo pētījumu kombināciju.
MRI vislabāk spēj vizualizēt prostatas dziedzera struktūru. Mūsdienu standarts iegurņa orgānu izmeklēšanai, izmantojot MRI metodi, ir endorektālā sensora izmantošana, kas ļauj iegūt attēlu ar visaugstāko iespējamo telpisko izšķirtspēju 0,5–1 mm. Gaisa iepludināšana endorektālajā sensorā nodrošina skaidru prostatas kapsulas, taisnstūra leņķu un Denonviljē taisnstūra prostatas fascijas vizualizāciju. Endorektālā sensora izmantošana MRI neierobežo reģionālo limfmezglu vizualizāciju (līdz vēdera aortas bifurkācijas līmenim). Prostatas vēzim raksturīga zema signāla intensitāte T2 svērtajos attēlos uz augstas intensitātes signāla fona no neizmainītas dziedzera perifērās zonas. Neregulāra forma, difūza izplatība ar masas efektu, izplūdušas un nelīdzenas kontūras ir zemas signāla intensitātes perēkļu morfoloģiskās īpašības prostatas dziedzera perifērajā zonā, kas liecina par bojājuma neoplastisku raksturu. Veicot dinamisko kontrastēšanu, vēža perēkļi ātri uzkrāj kontrastvielu arteriālajā fāzē un ātri to izvada, kas atspoguļo angioģenēzes pakāpi un attiecīgi audzēja ļaundabīguma pakāpi. Zema signāla intensitāte ir raksturīga arī pēcbiopsijas asiņošanas perēkļiem, prostatītam, dziedzera neitrālās zonas stromas labdabīgai hiperplāzijai, fibrocikātriālām izmaiņām, fibromuskulārai hiperplāzijai, hormonālās vai staru terapijas sekām. MRI bez dinamiskas kontrastēšanas neļauj droši diferencēt lielāko daļu uzskaitīto izmaiņu un slimību.
Kā minēts iepriekš, viens no jebkuras prostatas vēža attēldiagnostikas metodes galvenajiem uzdevumiem ir noteikt dziedzera bojājuma apjomu un audzēja izplatību ārpus kapsulas. Audzēja tilpuma noteikšana ir svarīga prognozei. Audzēja tilpums, kas mazāks par 4 cm3, norāda uz attālām metastāzēm, bet 12 cm3 - uz ārkārtīgi augstu metastāžu varbūtību. Saskaņā ar pētījumiem, MRI precizitāte prostatas dziedzera neoplastisko bojājumu perēkļu noteikšanā svārstās no 50 līdz 90%. MRI jutība prostatas vēža lokalizācijas noteikšanā ir aptuveni 70–80%, savukārt mikroskopiskus vēža perēkļus (foci) ar MRI nevar noteikt.
Endorektālās MRI vissvarīgākā priekšrocība ir spēja lokalizēt neoplastiskus bojājumus vietās, kas nav pieejamas citām diagnostikas metodēm, un precizēt audzēja augšanas raksturu un virzienu. Piemēram, MRI ļauj atklāt neoplastiskus bojājumus prostatas dziedzera perifērās zonas priekšējās daļās, kas nav pieejamas ar transrektālu biopsiju. Kopumā MRI būtiski papildina DRE un TRUS datus par audzēja lokalizāciju.
Endorektālā MRI ļauj vizualizēt dziedzera kapsulu, asinsvadu-nervu saišķus, sēklas pūslīšus, dziedzera virsotni, periprostatisko venozo pinumu un noteikt dziedzera audzēja lokālo izplatību. Jāuzsver, ka kapsulas penetrācija tiek uzskatīta par mikroskopisku pazīmi, un pat mūsdienu MRI ierīces (endorektālā spirāle) nespēj sniegt šādu informāciju. Iespējams iegūt datus tikai par augšanu ārpus dziedzera kapsulas.
Diagnostikas kritēriji ekstrakapsulārai pagarināšanai, izmantojot MRI:
- ekstrakapsulāra audzēja klātbūtne;
- nevienmērīga dziedzera kontūra (deformācija, leņķiskums);
- neirovaskulāro saišķu asimetrija;
- taisnstūra prostatas leņķu iznīcināšana;
- plašs audzēja kontakts ar kapsulu.
Augstākā specifiskums (līdz 95-98%) un MRI rezultātu precizitāte tiek sasniegta, izmeklējot pacientus ar vidēju vai augstu ekstrakapsulāras invāzijas risku. Tiek uzskatīts, ka ekstrakapsulāra invāzija (saskaņā ar MRI datiem) norāda uz ķirurģiskas ārstēšanas nepiemērotību un nelabvēlīgu slimības prognozi. Hormonālā vai staru terapija neietekmē prostatas audzēja ekstrakapsulāras izplatības noteikšanas precizitāti. Galvenās grūtības vēža perēkļu un audzēja ekstrakapsulāras izplatības noteikšanā ir tomogrammu interpretācijas lielā mainība dažādiem speciālistiem. Staru diagnostikas speciālista galvenais uzdevums ir panākt augstu diagnostisko specifiskumu (pat uz jutīguma rēķina), lai operējamiem pacientiem neatņemtu radikālas ārstēšanas iespēju.
Vēža, hiperplastisku un normālu prostatas audu blīvuma līdzība datortomogrāfijā padara šo metodi maznoderīgu audzēja lokālās izplatības novērtēšanai. Iebrukums sēklas pūslīšos ir svarīgāks par iebrukumu kapsulās, taču pat šajā gadījumā datortomogrāfija sniedz informāciju tikai progresējošos gadījumos. Tomēr šī metode tiek aktīvi izmantota, lai iezīmētu trieciena zonu pirms staru terapijas.
Lēnā staru diagnostikas attīstība mūsu valstī ir novedusi pie novēlotas prostatas vēža diagnostikas un līdz ar to pie nepietiekamas radikālu prostatas vēža ārstēšanas metožu (piemēram, prostatektomijas) izplatības, modernu tomogrāfu zemas pieejamības un atbilstošu apmācības programmu trūkuma staru diagnostikas speciālistiem un urologiem. Neskatoties uz to, ka datortomogrāfija un magnētiskās rezonanses attēlveidošana mūsdienās ir plaši izplatītas, kabinetu aprīkojuma līmenis un staru diagnostikas speciālistu izglītība nav pietiekama, lai iegūtā informācija kļūtu par izšķirošu ārstēšanas metodes izvēlē pacientiem ar prostatas vēzi.
Reģionālie limfmezgli (N)
Reģionālie limfmezgli jānovērtē tikai tad, ja tas tieši ietekmē ārstēšanas stratēģiju (parasti plānojot radikālu ārstēšanu). Augsts PSA līmenis, T2c -T3a audzēji, slikta diferenciācija un perineurāla invāzija ir saistīti ar augstu limfmezglu metastāžu risku. Limfmezglu stāvokļa novērtējums, pamatojoties uz PSA līmeni, tiek uzskatīts par nepietiekamu.
Tikai limfadenektomija (atklāta vai laparoskopiska) sniedz nepieciešamo informāciju. Jaunākie pētījumi par paplašinātu limfadenektomiju liecina, ka prostatas vēzis ne vienmēr skar obturatora limfmezglus. Asimptomātisku audzēju gadījumā un PSA līmeņa gadījumā zem 20 kg/ml. KT apstiprina palielinātus limfmezglus tikai 1% gadījumu. MRI vai KT izmantošana ir pamatota augsta metastāžu riska gadījumos, jo šo metožu specifiskums sasniedz 93–96%. Tomēr pat pozitīvs rezultāts, lietojot tās, var būt viltus, un tikai aizdomīga limfmezgla punkcija ļauj atteikties no limfadenektomijas. Saskaņā ar retrospektīvo analīzi, limfmezgla izmērs ne vienmēr norāda uz metastāžu klātbūtni tajā; skarto limfmezglu asimetrija tiek uzskatīta par informatīvāku pazīmi. Pašlaik tikai 2–3% pacientu, kuriem veikta radikāla prostatektomija lokalizēta prostatas vēža gadījumā, pēcoperācijas histoloģiskās izmeklēšanas laikā tiek diagnosticētas metastāzes limfmezglos.
Kā metodes metastāžu noteikšanai limfmezglos ieteicams izmantot pozitronu emisijas tomogrāfiju (PET) un scintigrāfiju ar iezīmētām antivielām, taču to izmantošana joprojām ir ierobežota nepietiekamas jutības dēļ.
Partina nomogrammas (2001) var izmantot, lai novērtētu reģionālo limfmezglu iesaistes risku. Nomogrammas ir matemātiski algoritmi, ko izmanto konkrētam pacientam vai pacientu grupai. Šīs tabulas ļauj noteikt lokālas audzēja izplatīšanās (līdz kapsulai, sēklas pūslīšiem) un limfmezglu iesaistes varbūtību, pamatojoties uz klīnisko stadiju, PSA līmeni un Glīsona indeksu. Jo īpaši tās ļauj identificēt pacientu grupu ar zemu (mazāk nekā 10%) limfmezglu metastāžu varbūtību (ar PSA līmeni virs 20 ng/md, T1-2a stadiju un Glīsona indeksu 2-6); šajā grupā limfmezglu stāvoklis pirms radikālas ārstēšanas var nebūt precizēts. Limfmezglu metastāžu risku var novērtēt arī, nosakot audzēja zonas ar izteiktu anaplaziju (4-5 punkti): ja šādas zonas ir atrodamas četrās vai vairāk biopsijās vai tās dominē vismaz vienā biopsijā, risks sasniedz 20-45%. Pārējiem pacientiem tas nepārsniedz 2,5%. Šādos gadījumos papildu izmeklēšana nav nepieciešama.
Attālas metastāzes (M)
85% pacientu, kas mirst no prostatas vēža, tiek atklāti aksiālā skeleta bojājumi. Kaulu metastāzes rodas vēža šūnu iekļūšanas dēļ kaulu smadzenēs ar asinsriti, kas noved pie audzēja augšanas un kaulu struktūru līzes. Kaulu metastāžu izplatība ietekmē prognozi, un to agrīna atklāšana brīdina ārstu par iespējamām komplikācijām. 70% gadījumu metastāzes tiek kombinētas ar kaulu izoenzīma sārmainās fosfatāzes (ALP) aktivitātes palielināšanos. ALP aktivitātes un PSA līmeņa noteikšana lielākajā daļā gadījumu ļauj atklāt kaulu metastāzes. Saskaņā ar daudzfaktoru analīzi, šos rādītājus ietekmē tikai kaulu metastāžu skaits. Ir svarīgi, lai kaulu izoenzīma ALP aktivitāte precīzāk atspoguļotu kaulu bojājuma pakāpi nekā PSA līmenis.
Scintigrāfija tiek uzskatīta par jutīgāko metodi kaulu metastāžu noteikšanai (tā ir pārāka par radiogrāfiju un sārmainās un skābās fosfatāzes aktivitātes noteikšanu). Tehnecija difosfonāti ir labāk izmantojami kā radiofarmaceitiskas zāles, jo to uzkrāšanās kaulos ir daudz aktīvāka nekā mīkstajos audos. Ir pierādīta korelācija starp kaulu bojājumu puskvantitatīvu novērtējumu un izdzīvošanu. Attālu metastāžu noteikšana ir iespējama jebkurā orgānā. Tās visbiežāk rodas nereģionālajos limfmezglos, plaušās, aknās, smadzenēs un ādā. Atbilstošu sūdzību un simptomu gadījumā to noteikšanai izmanto krūškurvja rentgenogrāfiju, ultraskaņu, datortomogrāfiju un magnētiskās rezonanses attēlveidošanu. Diagrammā ir parādīta taktika aizdomu gadījumā par kaulu metastāzēm.
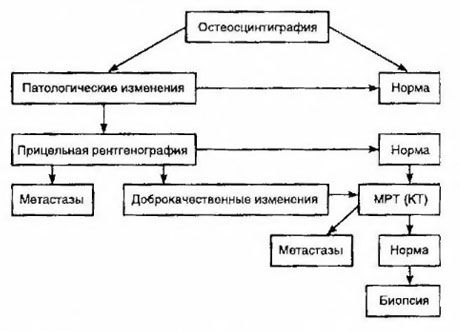
Visuzticamākais laboratorijas rādītājs, kas palīdz noteikt metastāžu pakāpi, ir PSA līmenis. Ir pierādīts, ka tā paaugstināšanās virs 100 ng/ml ir vienīgais parametrs, kas droši norāda uz attālām metastāzēm. PSA līmeņa noteikšana samazina pacientu skaitu, kuriem nepieciešama kaulu scintigrāfija. Kaulu metastāžu atklāšanas varbūtība ar PSA līmeņa pazemināšanos ir ļoti zema. Ja nav sūdzību un sākotnējais PSA saturs ir mazāks par 20 ng/ml, var izvairīties no scintigrāfijas, nosakot ļoti un vidēji diferencētus audzējus. Vienlaikus slikti diferencētu audzēju un kapsulas invāzijas gadījumā ir indicēta scintigrāfija (neatkarīgi no PSA līmeņa).


 [
[