Raksta medicīnas eksperts
Jaunas publikācijas
Subhondrālā kaula izmaiņu loma osteoartrīta patoģenēzē
Pēdējā pārskatīšana: 04.07.2025

Visi iLive saturs ir medicīniski pārskatīts vai pārbaudīts, lai nodrošinātu pēc iespējas lielāku faktisko precizitāti.
Mums ir stingras iegādes vadlīnijas un tikai saikne ar cienījamiem mediju portāliem, akadēmiskām pētniecības iestādēm un, ja vien iespējams, medicīniski salīdzinošiem pārskatiem. Ņemiet vērā, ka iekavās ([1], [2] uc) esošie numuri ir klikšķi uz šīm studijām.
Ja uzskatāt, ka kāds no mūsu saturiem ir neprecīzs, novecojis vai citādi apšaubāms, lūdzu, atlasiet to un nospiediet Ctrl + Enter.
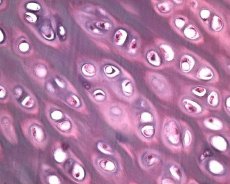
Līdz ar locītavu skrimšļa deģenerāciju, osteoartrīta patoloģiskajā procesā ir iesaistīti arī zem tā esošie kaulu audi. Tiek pieņemts, ka subhondrālās plāksnes sabiezēšana veicina osteoartrīta progresēšanu. Osteoartrītam progresējot, locītavu skrimslis, kas ir pakļauts mehāniskai un ķīmiskai slodzei, lēnām erodē skrimšļa katabolisma un reparācijas procesu nelīdzsvarotības dēļ. Jo īpaši mehāniskā slodze attiecībā uz locītavām, kas "nes" ķermeņa svaru, veicina liela skaita mikrolūzumu veidošanos subhondrālajā plāksnē un skrimšļos. Locītavu skrimšlim erodējot, progresē subhondrālā kaula skleroze, palielinās kaulaudu stingrība, kas savukārt veicina locītavu skrimšļa struktūras turpmākus traucējumus. Tomēr jautājums par subhondrālā kaula izmaiņu primāro vai sekundāro raksturu osteoartrīta gadījumā joprojām nav atrisināts.
Līdz nesenam laikam radiogrāfiski nosakāmas subhondrālā kaula porainās vielas izmaiņas, piemēram, skleroze vai cistu veidošanās, pacientiem ar osteoartrītu tika uzskatītas par sekundārām. Tomēr klīnisko un eksperimentālo pētījumu rezultāti liecina par iespējamu subhondrālā kaula ierosinošo lomu osteoartrīta patogenezē. Viens no iespējamiem mehānismiem ir straujš subhondrālā kaula stingrības gradienta pieaugums, jo pamatā esošā skrimšļa audu integritāte ir atkarīga no tā kaula "gultnes" mehāniskajām īpašībām. Pētījumi ar primātiem ir parādījuši, ka izmaiņas subhondrālajā kaulā var notikt pirms locītavu skrimšļa izmaiņām. Pierādījumi par un pret šo hipotēzi, kas radušies osteoartrīta dzīvnieku modeļu pētījumu un klīnisko pētījumu rezultātā, ir tikai pastiprinājuši debates. Trabekulu sabiezēšana subhondrālajā kaulā ne vienmēr ir saistīta ar kaula mineralizācijas palielināšanos vai drīzāk osteoīda tilpuma palielināšanos. Šī patoloģiskās mineralizācijas pazīme norāda, ka kaula remodelācijas regulācijas traucējumi ir neatņemama osteoartrīta sastāvdaļa, un arī atbalsta kaulu šūnu defekta koncepciju osteoartrīta gadījumā. J. Dekekera grupa (1989) pēdējo uzskata par "vispārinātu vielmaiņas kaulu slimību".
Kaula audi tiek pastāvīgi atjaunoti. Šis dinamiskais process, ko sauc par kaulu remodelāciju, ir sarežģīta rezorbcijas un mineralizācijas secība. Osteoklasti resorbē kaulu audus, un osteoblasti izdala olbaltumvielas, kas veido galveno organisko komponentu mineralizācijai. Kaula veidošanās un rezorbcija nenotiek nejauši visā skeletā; tas ir ieprogrammēts process, kas notiek dažādās skeleta zonās, ko sauc par kaulu remodelācijas vienībām. Cikla sākumā osteoklasti parādās uz neaktīvās virsmas; 2 nedēļu laikā tie veido tuneli kortikālajā kaulā vai lakūnu trabekulārā kaula virsmā. Jaunu kaulu remodelācijas vienību aktivācijas biežums nosaka kaulu atjaunošanās pakāpi. Veselam jaunam cilvēkam kaulu veidošanās un rezorbcijas procesi ir līdzsvaroti, un tiek saglabāta normāla kaulu masa. Kaula audu resorbcijas hormonālajā regulācijā piedalās vismaz PTH un PGE2 , ne tikai osteoklasti, bet arī osteoblasti, jo šo hormonu ietekmē tiek atbrīvoti faktori, kas stimulē kaulu resorbciju ar osteoklastiem. Pašlaik ir zināmi vairāk nekā 12 lokāli un sistēmiski kaulu audu augšanas regulatori, kas ietekmē to pārveidošanos, jo īpaši PTH, 1,25(OH)2D3 ,kalcitonīns, augšanas hormons, glikokortikoīdi, vairogdziedzera hormoni, insulīns, IGF (1 un 2), estrogēni, PGE2 , androgēni.
Kaulu šūnas izdala vairākus proteīnus un citokīnus, kas veic endokrīno regulāciju un signālu pārvadi. Osteoblastu ražotie proteīni ietver kaulu matrices proteīnus, piemēram, kolagēnu, osteopontīnu, osteokalcīnu, kaulu sialoproteīnus. Turklāt šīs šūnas izdala proteāzes gan aktīvā, gan latentā formā, kas piedalās kaulu audu remodelācijas procesā - MMP, plazminogēna aktivatora (PA)/plazmīna sistēmas komponentus. Osteoblastu izdalītie citokīni var iedarboties gan caur autokrīniem mehānismiem, gan ar parakrīniem ceļiem uz lokālām šūnām (citiem osteoblastiem, osteoklastiem).
Pagaidām nav zināms, vai šos signālus regulē mehānisks stress vai citi ķīmiskie signāli, ko izraisa mehānisks stress. Tomēr ir zināms, ka atkārtots mehānisks stress izraisa kaulu šūnu un/vai olbaltumvielu lokālu proliferāciju. In vivo mehāniskā slodze var aktivizēt osteoblastus, palielināt ciklisko nukleotīdu līmeni, prostaglandīnu veidošanos un izraisīt morfoloģiskas izmaiņas, kas saistītas ar kaulu remodelāciju. In vitro mehāniskais stress izraisa osteoblastu kultūru proliferāciju, osteoīdu veidošanā un mineralizācijā iesaistīto kaulu olbaltumvielu mRNS ekspresiju, lokālu augšanas faktoru, piemēram, IGF-1 un IGF-2, un adhēzijas molekulu izdalīšanos. Mehāniskā stresa signāla pārraidi var veikt, izmantojot mehānojutīgus jonu kanālus.
Pastāv netieši pierādījumi par osteoblastu disfunkciju osteoartrīta gadījumā. G. Gevers un J. Dequeker (1987) pierādīja seruma osteokalcīna līmeņa paaugstināšanos sievietēm ar rokas osteoartrītu, kā arī kortikālo kaulu eksplantātos, kas norāda, ka kaulu patoloģija var būt daļa no osteoartrīta. Autopsija atklāja ne tikai subhondrālā kaula sabiezēšanu, bet arī patoloģiski zemu augšstilba kaula galvas mineralizāciju. Jūrascūciņām ar ķirurģiski izraisītu osteoartrītu datortomogrāfija atklāja ievērojamu kaula frakcijas sabiezēšanu subhondrālajā zonā. Nelīdzsvarotība starp kolagēna un nekolagēna (osteokalcīna u.c.) olbaltumvielām var izraisīt kaula tilpuma palielināšanos, bet neietekmē tā minerālblīvumu. Saskaņā ar M. Shimizu et al. (1993) deģeneratīvu izmaiņu progresēšana locītavu skrimšļos ir saistīta ar intensīvāku subhondrālā kaula remodelāciju un tā stingrības palielināšanos, kas arī norāda uz kaulu audu šūnu defektu osteoartrīta gadījumā. Saskaņā ar B. Lī un M. Aspdena (1997) ierosināto hipotēzi, defektīvu kaulu šūnu proliferācija var izraisīt kaulu audu stingrības palielināšanos, bet neizraisa to minerālblīvuma palielināšanos.
CI Westacott et al. (1997) izvirzīja hipotēzi, ka patoloģiski osteoblasti tieši ietekmē skrimšļu metabolismu. Kultivējot osteoblastus no pacientiem ar osteoartrītu ar hondrocītiem no cilvēkiem, kuriem nebija locītavu slimību, autori in vitro novēroja būtiskas izmaiņas glikozaminoglikānu izdalīšanā normālos skrimšļa audos, bet citokīnu izdalīšanās līmenis nemainījās. G. Hilal et al. (1998) parādīja, ka osteoblastu kultūrai no pacientu ar osteoartrītu subhondrālā kaula in vitro ir izmainīts metabolisms - palielinās AP/plazmīna sistēmas aktivitāte un IGF-1 līmenis šajās šūnās. CI Westacott et al. (1997) novērojumu var izskaidrot ar proteāžu aktivitātes palielināšanos subhondrālā kaula šūnās.
Joprojām nav zināms, vai izmaiņas subhondrālajā kaulā ierosina osteoartrītu vai veicina tā progresēšanu. DK Dedrick et al. (1993) pierādīja, ka suņiem ar ķirurģiski izraisītu osteoartrītu subhondrālā kaula sabiezēšana nav nepieciešams nosacījums osteoartrītam līdzīgu izmaiņu attīstībai locītavu skrimšļos, bet gan veicina deģeneratīvu procesu progresēšanu skrimšļos. A. Sa'ied et al. (1997) pētījuma rezultāti ir pretrunā ar iepriekšējā pētījuma datiem. Izmantojot 50 MHz ehogrāfiju, lai novērtētu sākotnējās morfoloģiskās izmaiņas un to progresēšanu locītavu skrimšļos un kaulos eksperimentālā osteoartrīta gadījumā, ko izraisīja monojodietiķskābes injekcijas žurku ciskas locītavā, autori pierādīja vienlaicīgu kaulu un skrimšļu izmaiņu procesu pirmajās trīs dienās pēc injekcijas.
Osteoblasti izdala augšanas faktorus un citokīnus, kas iesaistīti lokālā kaulu remodelācijā, kas var veicināt pareizu skrimšļa remodelāciju "svaru nesošajās" locītavās pēc to iekļūšanas caur mikroplaisām locītavu skrimšļa kalcificētajā slānī. Turklāt kaulu šūnu sekrēcijas produkti ir atrodami sinoviālajā šķidrumā. Visticamākie produkti, ko izdala patoloģiski osteoblasti un kas var uzsākt lokālas skrimšļa remodelācijas procesu, ir TGF-b un kaulu morfometriskie proteīni (BMP). Abus TGF saimes locekļus izdala gan hondrocīti, gan osteoblasti, un abi spēj modificēt gan kaulu, gan skrimšļa remodelāciju. J. Martel Pelletier et al. (1997) novēroja TGF-β līmeņa paaugstināšanos pacientu ar osteoartrītu subhondrālo kaulu eksplantātos, salīdzinot ar veseliem indivīdiem, kas norāda uz šī augšanas faktora iespējamu lomu osteoartrīta patoģenēzē. IGF ražo arī osteoblasti. Osteoblastiem līdzīgu šūnu kultūrā, kas iegūta no pacientiem ar osteoartrītu, tika konstatēts IGF līmeņa paaugstināšanās, kas maina skrimšļa metabolismu.
TGF-b, IGF, BMP un citokīni, ko subhondrālajā kaulā producē osteoblasti, var ietekmēt kolagenāzes un citu proteolītisko enzīmu veidošanos skrimšļos, kas savukārt var veicināt skrimšļa matrices pārveidošanos/degradāciju. Joprojām nav skaidrs, vai osteoblasti osteoartrīta gadījumā producē mazāk makrofāgu koloniju stimulējošā faktora (M-CSF - kaulu rezorbcijas stimulators) nekā normālas šūnas. AG Uitterlindena u.c. (1997) pētījumu rezultāti parādīja, ka D vitamīna receptoriem, kurus ekspresē osteoblasti un kas regulē vairāku šo šūnu sintezētu faktoru ekspresiju, var būt zināma loma osteofītu veidošanā, kas daļēji izskaidro osteoblastu lomu šīs slimības patogenezē.
Ņemot vērā iepriekš minēto pētījumu rezultātus, G. Hilal et al. (1998), J. Martel-Pelletier et al. (1997) ierosināja šādu darba hipotēzi par saistību starp subhondrālā kaula remodelāciju un pareizu locītavu skrimšļa stāvokli osteoartrīta gadījumā. OA patoģenēzes agrīnā vai progresējošā stadijā kaulu audu remodelācijas process subhondrālajā kaulā pastiprinās. Vienlaikus atkārtota slodze noved pie lokālām mikrolūzumiem un/vai nelīdzsvarotības parādīšanos IGF/IGF saistošā proteīna (IGFBP) sistēmā subhondrālā kaula osteoblastu patoloģiskas reakcijas dēļ, kas veicina tā sklerozi. Pēdējais savukārt var veicināt pareizu skrimšļa stāvokli un tā matricas bojājumus.
Normālos apstākļos šo bojājumu novērš lokāla IGF-1 un IGF saistošā proteīna sintēze un izdalīšanās, kas stimulē locītavu skrimšļa ECM veidošanos. Vienlaikus GF sistēma veicina subhondrālo kaulu šūnu augšanu un kaulu matrices veidošanos. Osteoartrīta pacientu subhondrālajā kaulā IGF sistēmas anaboliskā aktivitāte palielinās, savukārt AP/plazmīna sistēmas (IGF sistēmas lokālā regulatora) lokāla aktivācija locītavu skrimšļos izraisa tā lokālas izmaiņas. Osteoartrīta osteoblastos IGF-1 pārtrauc AP regulāciju ar plazmīnu, izmantojot pozitīvās atgriezeniskās saites tipu, tāpēc tas var ierobežot remodelāciju kaulu audos, kas galu galā noved pie subhondrālas sklerozes. Tādējādi kaulu un skrimšļu audos lokāla IGF-1 un proteāžu indukcija noved, no vienas puses, pie skrimšļa bojājumiem, no otras puses, pie subhondrāla kaula sabiezēšanas, pēdējais savukārt veicina turpmākus skrimšļa bojājumus. Nelīdzsvarotība starp skrimšļa bojājumiem, kas saistīti ar subhondrālu sklerozi, un tā reparatīvajām spējām noved pie progresējošām izmaiņām skrimšļa ārējās membrānas masā (ECM) un osteoartrīta attīstības. Pēc autoru domām, šī hipotēze izskaidro arī slimības lēno progresēšanu.

