Jaunas publikācijas
Cilvēka imūndeficīta vīruss (HIV)
Last reviewed: 01.06.2018

Mums ir stingras avotu izmantošanas vadlīnijas, un mēs ievietojam saites tikai uz cienījamām medicīnas vietnēm, akadēmiskām pētniecības iestādēm un, kad vien iespējams, medicīniski recenzētiem pētījumiem. Ņemiet vērā, ka iekavās esošie skaitļi ([1], [2] utt.) ir noklikšķināmas saites uz šiem pētījumiem.
Ja uzskatāt, ka kāds no mūsu satura ir neprecīzs, novecojis vai citādi apšaubāms, lūdzu, atlasiet to un nospiediet Ctrl + Enter.
Iegūtā imūndeficīta sindroms kā specifiska slimība tika identificēta 1981. gadā Amerikas Savienotajās Valstīs, kad vairākiem jauniešiem attīstījās nopietnas slimības, ko izraisīja mikroorganismi, kas veseliem cilvēkiem nebija patogēni vai bija vāji patogēni. Pētot pacientu imūno stāvokli, tika atklāts straujš limfocītu skaita samazinājums kopumā un jo īpaši T-helperu skaita samazinājums. Šo stāvokli sauca par AIDS (iegūtā imūndeficīta sindroms). Infekcijas metode (seksuāls kontakts, ar asinīm un to preparātiem) norādīja uz slimības infekciozo raksturu.
AIDS izraisītāju 1983. gadā neatkarīgi atklāja francūzis L. Montanjē, kurš to nosauca par LAV limfoadenopātijā asociēto vīrusu, jo viņš to atrada pacientam ar limfadenopātiju; un amerikānis R. Gallo, kurš vīrusu nosauca par HTLV-III (cilvēka T-limfotropo vīrusu III): viņš iepriekš bija atklājis limfotropos vīrusus I un II.
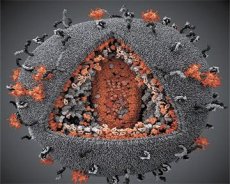
Salīdzinot LAV un HTLV-III vīrusu īpašības, tika atklāta to identitāte, tāpēc, lai izvairītos no neskaidrībām, 1986. gadā vīruss tika nosaukts par HIV (cilvēka imūndeficīta vīruss jeb HIV). HIV ir sfēriska forma, ar diametru 110 nm. Vīrusa apvalkam ir daudzstūra forma, kas sastāv no 12 piecstūriem un 20 sešstūriem. Katra sešstūra centrā un stūros atrodas glikozilēta proteīna gpl20 molekula (skaitlis 120 norāda proteīna molekulmasu kilodaltonos). Kopumā 72 gpl20 molekulas atrodas uz viriona virsmas savdabīgu tapu veidā, no kurām katra ir saistīta ar intramembrānas proteīnu gp41. Šie proteīni kopā ar dubulto lipīdu slāni veido viriona superkapsīdu (membrānu).
Gpl20 un gp41 proteīni veidojas, šūnu proteāzei pārgriežot Env prekursora proteīnu. gp41 proteīns veido adatas "kātu", saistoties ar savu citoplazmas domēnu ar matricas proteīnu p17MA, kas atrodas tieši zem apvalka. Viriona nobriešanas laikā p17 molekulas mijiedarbojas, veidojot ikosaedru zem apvalka.
Viriona centrālajā daļā p24 proteīns veido konusa formas kapsīdu. Kapsīda sašaurinātā daļa ir savienota ar viriona membrānu, piedaloties rb proteīnam. Kapsīda iekšpusē atrodas divas identiskas vīrusu genoma RNS molekulas. Tās ar 5' galiem ir savienotas ar nukleokapsīda proteīnu p7NC. Šis proteīns ir interesants, jo tam ir divi aminoskābju atlikumi (motīvi), kas bagāti ar cisteīnu un histidīnu un satur Zn atomu - tos sauc par "cinka pirkstiem", jo tie uztver genoma RNS molekulas iekļaušanai veidojošajos virionos. Kapsīds satur arī trīs enzīmus. Revertāze (RT) jeb pol komplekss ietver reverso transkriptāzi, RNāzi H un DNS atkarīgo DNS polimerāzi. Revertāze atrodas kā heterodimērs p66/p51. Proteāze (PR) - p10 - ierosina un īsteno viriona nobriešanas procesu. Integrāze (IN) - p31 jeb endonukleāze nodrošina provīrusu DNS iekļaušanu saimniekšūnas genomā. Kapsīds satur arī praimera RNS molekulu (tRNAl"3).
Šūnā esošais RNS genoms ar reversās transkriptāzes palīdzību tiek pārveidots par DNS genomu (DNS provīrusu), kas sastāv no 9283 nukleotīdu pāriem. To kreisajā un labajā pusē ierobežo tā sauktie garie terminālie atkārtojumi jeb LTR: S'-LTR kreisajā pusē un 3'-LTR labajā pusē. LTR satur 638 nukleotīdu pārus katrā.
HIV genoms sastāv no 9 gēniem, no kuriem daži pārklājas galos (tiem ir vairāki lasīšanas rāmji) un tiem ir eksonintrona struktūra. Tie kontrolē 9 strukturālo un 6 regulējošo olbaltumvielu sintēzi.
LTR nozīme vīrusa genomā ir tāda, ka tie satur šādus regulējošus elementus, kas kontrolē tā darbību:
- transkripcijas signāls (promotora reģions);
- poli-A pievienošanas signāls;
- ierobežošanas signāls;
- integrācijas signāls;
- pozitīvs regulācijas signāls (TAR TAT proteīnam);
- negatīvs regulējošais elements (NRE NEF proteīnam);
- vieta praimera RNS (tRNA™3) piestiprināšanai mīnus virknes DNS sintēzei 3' galā; signāls LTR 5' galā, kas kalpo kā praimeris plus virknes DNS sintēzei.
Turklāt LTR satur elementus, kas iesaistīti mRNS splaisinga regulēšanā, vRNS molekulu iepakošanā kapsīdā (Psi elements). Visbeidzot, genoma transkripcijas laikā garajās mRNS veidojas divi signāli REV proteīnam, kas pārslēdz proteīnu sintēzi: CAR - regulatorajiem proteīniem un CRS - strukturālajiem proteīniem. Ja REV proteīns saistās ar CAR, tiek sintezēti strukturālie proteīni; ja tā nav, tiek sintezēti tikai regulējošie proteīni.
Īpaši svarīga loma vīrusa genoma darbības regulēšanā ir šādiem regulējošiem gēniem un to proteīniem:
- TAT proteīns, kas veic pozitīvu vīrusu replikācijas kontroli un darbojas caur TAR regulējošo reģionu;
- NEV un VPU proteīni, kas negatīvi kontrolē replikāciju caur NRE reģionu;
- REV proteīns, kas veic pozitīvi negatīvu kontroli. REV proteīns kontrolē gag, pol, env gēnu darbu un veic splaisinga negatīvo regulāciju.
Tādējādi HIV replikācija notiek trīskāršā kontrolē – pozitīvā, negatīvā un pozitīvi-negatīvā.
VIF proteīns nosaka jaunizveidotā vīrusa infekciozitāti. Tas ir saistīts ar p24 kapsīda proteīnu un virionā ir 60 molekulu daudzumā. NEF proteīnu virionā pārstāv neliels skaits molekulu (5–10), iespējams, saistītas ar apvalku.
VPR proteīns kavē šūnu ciklu G2 fāzē, piedalās preintegrācijas kompleksu transportēšanā uz šūnas kodolu, aktivizē dažus vīrusu un šūnu gēnus un palielina vīrusu replikācijas efektivitāti monocītos un makrofāgos. VPR, TAT, REV un VPU proteīnu atrašanās vieta virionā nav noteikta.
Papildus saviem proteīniem viriona membrāna var saturēt dažus saimniekšūnas proteīnus. VPU un VPR proteīni piedalās vīrusu reprodukcijas regulēšanā.
Cilvēka imūndeficīta vīrusa (HIV) antigēniskie varianti
Cilvēka imūndeficīta vīruss (HIV) ir ļoti mainīgs. Pat no viena pacienta organisma var izolēt vīrusa celmus, kas būtiski atšķiras pēc antigēnām īpašībām. Šādu mainīgumu veicina intensīva CD4+ šūnu iznīcināšana un spēcīga antivielu atbilde uz HIV infekciju. No pacientiem no Rietumāfrikas ir izolēta jauna HIV forma - HIV-2, kas bioloģiski ir tuva HIV-1, bet imunoloģiski atšķiras no tā. Šo vīrusu genomu primārās struktūras homoloģija ir 42%. DNS provīruss HIV-2 satur 9671 bp, bet tā LTR - 854 bp. Pēc tam HIV-2 tika izolēts arī citos pasaules reģionos. Starp HIV-1 un HIV-2 nav krusteniskās imunitātes. Ir zināmas divas lielas HIV-1 formas: O (ārpusdzimuma) un M (galvenais), pēdējais ir iedalīts 10 apakštipos (AJ). Krievijā cirkulē astoņi apakštipi (AH).
 [ 1 ], [ 2 ], [ 3 ], [ 4 ], [ 5 ], [ 6 ], [ 7 ], [ 8 ], [ 9 ], [ 10 ]
[ 1 ], [ 2 ], [ 3 ], [ 4 ], [ 5 ], [ 6 ], [ 7 ], [ 8 ], [ 9 ], [ 10 ]
HIV mijiedarbības mehānisms ar šūnu
Iekļūdams organismā, vīruss vispirms uzbrūk šūnām, kas satur tam specifisku CD4 receptoru. Šis receptors lielā daudzumā ir T-helperos, mazākā daudzumā makrofāgos un monocītos, un T-helperu šūnas ir īpaši jutīgas pret vīrusu.
Cilvēka imūndeficīta vīruss (HIV) atpazīst CD4 receptorus, izmantojot tā gpl20 proteīnu. HIV mijiedarbības process ar šūnu notiek pēc šādas shēmas: receptoru mediēta adsorbcija -> pārklāta bedre -> pārklāta pūslīte -> lizosoma. Tajā viriona membrāna saplūst ar lizosomas membrānu, un nukleokapsīds, atbrīvojies no superkapsīda, nonāk citoplazmā; ceļā uz kodolu tas tiek iznīcināts, un tiek atbrīvota genoma RNS un saistītie kodola komponenti. Pēc tam reversā transkriptāze sintezē DNS mīnusa virkni uz viriona RNS, tad RNāze H iznīcina viriona RNS, un vīrusu DNS polimerāze sintezē DNS plusa virkni. DNS provīrusa galos veidojas 5'-LTR un 3'-LTR. DNS provīruss kādu laiku var palikt kodolā neaktīvā formā, bet agrāk vai vēlāk tas ar integrāzes palīdzību tiek integrēts mērķa šūnas hromosomā. Tajā provīruss paliek neaktīvs, līdz doto T-limfocītu aktivizē mikrobiālie antigēni vai citas imūnkompetentas šūnas. Šūnu DNS transkripcijas aktivāciju regulē īpašs kodolfaktors (NF-kB). Tas ir DNS saistošs proteīns, kas lielos daudzumos tiek ražots T-limfocītu un monocītu aktivācijas un proliferācijas laikā. Šis proteīns saistās ar noteiktām šūnu DNS sekvencēm un līdzīgām DNS provīrusa LTR sekvencēm un inducē gan šūnu DNS, gan DNS provīrusa transkripciju. Inducējot DNS provīrusa transkripciju, tas veic vīrusa pāreju no neaktīva stāvokļa uz aktīvu un attiecīgi no pastāvīgas infekcijas uz produktīvu. Provīruss var palikt neaktīvā stāvoklī ļoti ilgu laiku. Vīrusa aktivācija ir kritisks brīdis tā mijiedarbībā ar šūnu.
No brīža, kad vīruss iekļūst šūnā, sākas HIV infekcijas periods – vīrusa nesēja stāvoklis, kas var ilgt 10 gadus vai ilgāk; un no brīža, kad vīruss tiek aktivizēts, sākas slimība – AIDS. Ar savu regulējošo gēnu un to produktu palīdzību vīruss sāk aktīvi vairoties. TAT proteīns var palielināt vīrusa reprodukcijas ātrumu 1000 reizes. Vīrusu transkripcija ir sarežģīta. Tā ietver gan pilna garuma, gan subgenomiskas mRNS veidošanos, mRNS splaisingu un pēc tam strukturālo un regulējošo proteīnu sintēzi.
Strukturālo olbaltumvielu sintēze notiek šādi. Vispirms tiek sintezēts Pr55Gag prekursora poliproteīns (olbaltumviela ar molekulmasu 55 kDa). Tā satur 4 galvenos domēnus: matricu (MA), kapsīdu (CA), nukleokapsīdu (NC) un rb domēnu, no kuriem, vīrusu proteāzei sagriežot Pr55Gag (tas tiek pats sagriezts no cita prekursora proteīna Gag-Pol), attiecīgi veidojas strukturālie proteīni p17, p24, p7 un rb. Pr55Gag poliproteīna veidošanās ir galvenais nosacījums vīrusu daļiņu veidošanās procesam. Tieši šis proteīns nosaka viriona morfoģenēzes programmu. Tā secīgi ietver Gag poliproteīna transportēšanas uz plazmas membrānu, mijiedarbības ar to un olbaltumvielu-olbaltumvielu mijiedarbības posmus vīrusu daļiņas veidošanās un tās pumpurošanās laikā. Pr55Gag tiek sintezēts uz brīvām poliribosomām; olbaltumvielu molekulas tiek transportētas uz membrānu, kur tās tiek nostiprinātas ar to hidrofobajiem reģioniem. CA domēnam ir galvenā loma Gag proteīna dabiskās konformācijas veidošanā. NC domēns nodrošina divu genoma RNS molekulu iekļaušanu (ar savu "cinka pirkstu" palīdzību) veidojošās vīrusa daļiņas sastāvā. Poliproteīna molekula sākotnēji dimerizējas matricas domēnu mijiedarbības rezultātā. Pēc tam dimēri CA un NC domēnu mijiedarbības rezultātā apvienojas heksamēru (6 vienību) kompleksos. Visbeidzot, heksamēri, savienojoties pie sānu virsmām, veido nenobriedušus sfēriskus virionus, kuru iekšpusē atrodas genoma vīrusa RNS, ko uztver NC domēns.
Vēl viens prekursora proteīns Prl60Gag-Pol (proteīns ar molekulmasu 160 kDa) tiek sintezēts ribosomas translācijas rāmja nobīdes rezultātā gag gēna 3'-gala translācijas laikā reģionā, kas atrodas tieši augšpus rb proteīnu kodējošā reģiona. Šis Gag-Pol poliproteīns satur nepilnīgu Gag proteīna secību (1-423 aminoskābes) un Pol sekvences, kas ietver PR, RT un IN domēnus. Gag-Pol poliproteīna molekulas tiek sintezētas arī uz brīvām poliribosomām un tiek transportētas uz plazmas membrānu. Prl60Gagpol poliproteīns satur visas starpmolekulārās mijiedarbības vietas un membrānas saistīšanās vietas, kas raksturīgas Gag poliproteīnam. Tādēļ Gag-Pol poliproteīna molekulas saplūst ar membrānu un kopā ar Gag molekulām tiek iekļautas veidojošajos virionos, kā rezultātā parādās aktīva proteāze un sākas virionu nobriešanas process. HIV-1 proteāze ir ļoti aktīva tikai dimēra veidā, tāpēc tās pašizgriešanai no Prl60Gag-Pol ir nepieciešama šo molekulu dimerizācija. Viriona nobriešana sastāv no tā, ka atbrīvotā aktīvā proteāze sagriež prl60Gag-Pol un Gag55 tās atpazītajās vietās; veidojas proteīni p17, p24, p7, p6, revertāze, integrāze un notiek to saistīšanās ar vīrusa struktūru.
Env proteīns tiek sintezēts ribosomās, kas saistītas ar endoplazmatiskā tīkla membrānām, pēc tam tas tiek glikozilēts, ar šūnu proteāzes palīdzību sašķelts līdz gp120 un gp41 un transportēts uz šūnas virsmu. Šajā gadījumā gp41 iekļūst membrānā un saistās ar Gag proteīna molekulas matricas domēniem, kas saistīti ar membrānas iekšējo virsmu. Šī saikne saglabājas nobriedušā virionā.
Tādējādi vīrusu daļiņu montāža sastāv no prekursorproteīnu un saistīto RNS molekulu agregācijas uz saimniekšūnas plazmas membrānas, nenobriedušu virionu veidošanās un to atbrīvošanas, pumpurojoties no šūnas virsmas. Pumpurošanās laikā virions sevi ieskauj ar šūnas membrānu, kurā iestrādājas gp41 un gp120 molekulas. Pumpurošanās laikā vai, iespējams, pēc virionu atbrīvošanas notiek to nobriešana, kas tiek veikta ar vīrusu proteāzes palīdzību un sastāv no prekursorproteīnu Pr55Gag un Prl60Gag-Pol proteolītiskas sagriešanas nobrieduša vīrusa proteīnos un to apvienošanas noteiktos strukturālos kompleksos. Vadošo lomu vīrusu morfoģenēzes procesos spēlē prekursorpoliproteīns Pr55Gag, kas organizē un montē nenobriedušu virionu; tā nobriešanas procesu pabeidz specifiska vīrusu proteāze.
Imūndeficīta cēloņi
Viens no galvenajiem imūndeficīta cēloņiem HIV infekcijā ir T-palīgu masveida nāve. Tā notiek šādu notikumu rezultātā. Pirmkārt, ar vīrusu inficētie T-palīgi iet bojā apoptozes dēļ. Tiek uzskatīts, ka AIDS pacientiem vīrusa replikācija, apoptoze un T-palīgu skaita samazināšanās ir savstarpēji saistītas. Otrkārt, T-killeri atpazīst un iznīcina ar vīrusu inficētas vai adsorbētas gpl20 molekulas nesošas T-šūnas, kā arī ar vīrusu inficētus un neinficētus T-palīgus, kas veido simplastus (sincītijus), kas sastāv no vairākiem desmitiem šūnu (dažas no tām iet bojā vīrusu vairošanās rezultātā tajās). Liela skaita T-palīgu iznīcināšanas rezultātā samazinās membrānas receptoru ekspresija B-limfocītos pret interleikīnu-2, tiek traucēta dažādu interleikīnu (B-limfocītu augšanas un diferenciācijas faktoru - IL-4, IL-5, IL-6 utt.) sintēze, kā rezultātā tiek traucēta T-killeru sistēmas darbība. Komplementa un makrofāgu sistēmu aktivitāte tiek nomākta. Ar vīrusu inficētie makrofāgi un monocīti ilgstoši nemirst, bet tie nespēj izvadīt vīrusu no organisma. Visbeidzot, gpl20 strukturālās un antigēniskās līdzības dēļ ar dažu organisma epitēlija šūnu receptoriem (tostarp trofoblastu receptoriem, kas mediē HIV transplantācijas pārnešanu) tiek sintezētas antireceptoru antivielas ar plašu darbības spektru. Šādas antivielas spēj bloķēt dažādus šūnu receptorus un sarežģīt slimības gaitu ar autoimūniem traucējumiem. HIV infekcijas sekas ir visu galveno imūnsistēmas saikņu sakāve. Šādi pacienti kļūst neaizsargāti pret plašu mikroorganismu klāstu. Tas noved pie oportūnistisku infekciju un audzēju attīstības. Pacientiem ar HIV infekciju palielinās vismaz trīs vēža veidu attīstības risks: Kapoši sarkoma; karcinoma (tostarp ādas vēzis); B šūnu limfoma, kas rodas B limfocītu ļaundabīgas transformācijas dēļ. Tomēr HIV ir ne tikai limfocitotropisks, bet arī neirotropisks. Tas iekļūst centrālās nervu sistēmas šūnās (astrocītos) gan ar receptoru mediētas endocitozes palīdzību, gan ar vīrusu inficētu limfoblastu fagocitozi, ko veic astrocīti. Vīrusam mijiedarbojoties ar astrocītiem, veidojas arī simplasti, kas veicina patogēna izplatīšanos pa starpšūnu kanāliem. Vīruss ilgstoši var saglabāties makrofāgos un monocītos, tāpēc tie kalpo kā tā rezervuārs un izplatītāji organismā, spējot iekļūt visos audos. Inficētajiem makrofāgiem ir liela nozīme HIV ievadīšanā centrālajā nervu sistēmā un tās bojājumos. 10% pacientu primārie klīniskie sindromi ir saistīti ar centrālās nervu sistēmas bojājumiem un izpaužas kā demence. Tādējādi cilvēkiem, kas inficēti ar HIV, raksturīgas 3 slimību grupas - oportūnistiskas infekcijas,audzēja slimības un centrālās nervu sistēmas bojājumi.
HIV infekcijas epidemioloģija
HIV infekcijas avots ir tikai cilvēks – slims cilvēks vai vīrusa nesējs. Cilvēka imūndeficīta vīruss (HIV) ir atrodams asinīs, spermā, dzemdes kakla šķidrumā; barojošām mātēm – mātes pienā. Infekcija notiek seksuāli, ar asinīm un to preparātiem, kā arī no mātes bērnam pirms, dzemdību laikā un pēc tām. Nav zināmi inficēšanās gadījumi ar vīrusu, izmantojot pārtiku, dzērienus un kukaiņu kodus.
Narkotiku atkarība veicina AIDS izplatību. HIV saslimstība katru gadu pieaug. Saskaņā ar PVO datiem no 1980. līdz 2000. gadam ar HIV bija inficēti 58 miljoni cilvēku. Tikai 2000. gadā visā pasaulē bija inficēti 5,3 miljoni cilvēku, un 3 miljoni cilvēku nomira no AIDS. Uz 2004. gada 1. janvāri Krievijā bija reģistrēti 264 tūkstoši HIV inficētu cilvēku. Puse no HIV inficētajiem cilvēkiem mirst 11–12 gadu laikā no inficēšanās brīža. 2004. gada sākumā no katriem 100 tūkstošiem Krievijas iedzīvotāju aptuveni 180 dzīvoja ar diagnozi "HIV infekcija". Tiek prognozēts, ka ar šādu saslimstības līmeni kopējais HIV inficēto cilvēku skaits Krievijā līdz 2012. gadam būs 2,5–3 miljoni cilvēku. Cīņas pret HIV infekciju sarežģītība ir atkarīga no vairākiem iemesliem: pirmkārt, nav efektīvu tās ārstēšanas un specifiskas profilakses metožu; otrkārt, HIV infekcijas inkubācijas periods var pārsniegt 10 gadus. Tā ilgums ir atkarīgs no T-limfocītu un tā hromosomā esošā DNS provīrusa aktivācijas brīža. Joprojām nav skaidrs, vai visi, kas inficēti ar vīrusu, ir lemti AIDS, vai arī ir iespējama ilgstoša vīrusa nēsāšana bez slimības (kas šķiet maz ticams). Visbeidzot, pastāv vairāki cilvēka imūndeficīta vīrusi (HIV-1, HIV-2), kuru antigēnās atšķirības novērš krusteniskās imunitātes veidošanos. Pērtiķu imūndeficīta vīrusa (SIV) atklāšana izgaismoja jautājumu par HIV izcelsmi. SIV ir līdzīgs HIV pēc savas genoma organizācijas, bet būtiski atšķiras pēc nukleotīdu secības. HIV-2 pēc savām seroloģiskajām īpašībām ieņem starpposmu starp HIV-1 un SIV un pēc nukleotīdu secības ir tuvāks SIV. Šajā sakarā V. M. Ždanovs ieteica, ka HIV-1, HIV-2 un SIV vīrusi cēlušies no kopīga senča. Pēc R. Gallo domām, iespējams, ka viens no SIV kaut kādā veidā iekļuva cilvēka organismā, kur piedzīvoja virkni mutāciju, kā rezultātā parādījās HIV-1, HIV-2 un citas tā formas.
HIV infekcijas simptomi
Cilvēka imūndeficīta vīrusam piemīt dažas iezīmes, kas lielā mērā nosaka slimības patogenezi. Vīrusam ir ļoti augsts reprodukcijas ātrums, ko nosaka tā regulējošie elementi (aktīvajā stadijā 5 minūšu laikā tiek sintezēti līdz 5000 virioniem). Saplūšanas proteīna (gp41) klātbūtnes dēļ vīruss izraisa plašu sincitiālo struktūru veidošanos inficēto un neinficēto T-palīgu saplūšanas dēļ, kā rezultātā tie masveidā iet bojā. Lielos daudzumos izveidotās gpl20 proteīna molekulas brīvi cirkulē asinīs un saistās ar neinficēto T-palīgu receptoriem, kā rezultātā tās arī atpazīst un iznīcina T-killeri. Vīruss var izplatīties pa starpšūnu kanāliem no šūnas uz šūnu, un tādā gadījumā tas kļūst grūti pieejams antivielām.
HIV infekcijas klīniskie kritēriji
Pieaugušajiem HIV infekcija tiek diagnosticēta, ja viņiem ir vismaz divi nopietni simptomi kombinācijā ar vismaz vienu nelielu simptomu un ja nav citu zināmu imūndeficīta cēloņu (vēzis, iedzimts imūndeficīts, smaga bada utt.). Nopietni simptomi ir:
- svara zudums par 10% vai vairāk;
- ilgstošs drudža stāvoklis, periodisks vai pastāvīgs;
- hroniska caureja.
Nelieli simptomi: pastāvīgs klepus, ģeneralizēts dermatīts, recidivējoša jostas roze, mutes dobuma un rīkles kandidoze, hroniska herpes simplex infekcija, ģeneralizēta limfadenopātija. AIDS diagnoze tiek noteikta tikai Kapoši sarkomas, kriptokoku meningīta, pneimocistīta pneimonijas klātbūtnē. Slimības klīnisko ainu ietekmē pavadošā oportūnistiskā infekcija.
Cilvēka imūndeficīta vīrusa (HIV) kultivēšanas metodes
HIV-1 un HIV-2 var kultivēt tikai viena TCV4 limfocītu klona - H9 - šūnās, kas iegūts no leikēmiskiem TCV4 limfocītiem. Šiem nolūkiem var izmantot arī astrocītu šūnu monoslāņa kultūras, kurās HIV-1 labi vairojas. Šimpanzes ir uzņēmīgas pret HIV-1 dzīvnieku vidū.
Vīrusa rezistence ārējā vidē ir zema. Tas iet bojā saules gaismas un UV starojuma ietekmē, 80 °C temperatūrā tiek iznīcināts 30 minūšu laikā, apstrādājot ar parasti lietojamiem dezinfekcijas līdzekļiem - 20-30 minūšu laikā. Lai dezinficētu vīrusu saturošu materiālu, nepieciešams izmantot mikobaktericīdus dezinfekcijas līdzekļus, jo tie ir efektīvi pret mikroorganismiem ar visaugstāko rezistenci.
HIV infekcijas laboratoriskā diagnostika
Galvenā vīrusa nēsāšanas un HIV infekcijas diagnostikas metode ir enzīmu imūnanalīze. Tomēr, ņemot vērā faktu, ka gpl20 ir strukturāla un antigēnu līdzība ar dažu cilvēka šūnu receptoriem, tostarp receptoriem, kas transportē imūnglobulīnus caur gļotādu epitēlija šūnām, organismā var parādīties antivielas, kas saistītas ar antivielām pret gpl20. Šajā gadījumā var būt viltus pozitīvi ELISA rezultāti. Tāpēc visiem pozitīvi reaģējošajiem subjektu serumiem tiek veikta papildu analīze, izmantojot imūnblotēšanas metodi jeb Western blotēšanu. Šī metode balstās uz pētāmo antivielu identificēšanu pēc to elektroforētiskās atdalīšanas un sekojošas testēšanas, izmantojot iezīmētas antivielas pret sugām. Virusoloģiskā metode tiek reti izmantota vīrusa kultivēšanas sarežģītības dēļ. H9 limfocītu klons tiek izmantots, lai iegūtu vīrusu antigēnus - nepieciešamās diagnostikas testu sistēmu sastāvdaļas. CPR metode ļauj noteikt vīrusu virēmijas agrīnā stadijā.
HIV infekcijas ārstēšana
Ir nepieciešams atrast vai sintezēt zāles, kas efektīvi nomāc reversās transkriptāzes (revertāzes) vai vīrusu proteāzes aktivitāti. Tās novērstu DNS provīrusa veidošanos un (vai) kavētu vīrusa intracelulāro reprodukciju. Mūsdienu HIV inficēto pacientu ārstēšanas stratēģija balstās uz principu par zāļu, kas nomāc vīrusu proteāzi (viena no zālēm) un reversāzi (2 dažādas zāles), kombinētu lietošanu - kombinētu (trīskāršu) terapiju. Krievijā HIV inficēto pacientu ārstēšanai ieteicams kombinēti lietot 2 vietējās zāles: fosfazīdu un kriksivānu, kas specifiski nomāc HIV reprodukciju agrīnā un vēlīnā reprodukcijas stadijā, īpaši ar samazinātu azidotimidīna aktivitāti.
Specifiskās profilakses problēma ir nepieciešamība izveidot vakcīnu, kas nodrošinātu efektīvas šūnu mediētas imunitātes veidošanos, kuras pamatā būtu vīrusam specifiski citotoksiski limfocīti, bez būtiskas antivielu veidošanās. Šādu imunitāti nodrošina Thl palīgi. Iespējams, ka antivielas, tostarp vīrusu neitralizējošās, ir ne tikai neefektīvas HIV infekcijas nomākšanā, bet augstā līmenī tās nomāc šūnu mediēto imunitāti. Tāpēc pret-HIV vakcīnai, pirmkārt, jāatbilst divām galvenajām prasībām: a) tai jābūt absolūti drošai un b) jāstimulē T-citotoksisko limfocītu aktivitāte. Tiek pētīta dažādu vakcīnas variantu, kas iegūti no nogalinātiem (inaktivētiem) vīrusiem un no atsevišķiem antigēniem ar augstām aizsargājošām īpašībām, efektivitāte. Šādus antigēnus var izolēt no pašiem virioniem vai sintezēt ķīmiski. Ir ierosināta vakcīna, kas izveidota, pamatojoties uz ģenētiskās inženierijas metodēm. Tas ir rekombinants vaccinia vīruss, kas nes HIV gēnus, kas atbild par antigēnu ar spēcīgām imunogēnām īpašībām sintēzi. Jautājums par šo vakcīnu efektivitāti prasa ievērojamu laiku, jo HIV infekcijas inkubācijas periods ir ilgs un patogēna mainīgums ir augsts. Ļoti efektīvas vakcīnas pret HIV izveide ir steidzama fundamentāla problēma.
