Raksta medicīnas eksperts
Jaunas publikācijas
B hepatīta patoģenēze
Pēdējā pārskatīšana: 07.07.2025

Visi iLive saturs ir medicīniski pārskatīts vai pārbaudīts, lai nodrošinātu pēc iespējas lielāku faktisko precizitāti.
Mums ir stingras iegādes vadlīnijas un tikai saikne ar cienījamiem mediju portāliem, akadēmiskām pētniecības iestādēm un, ja vien iespējams, medicīniski salīdzinošiem pārskatiem. Ņemiet vērā, ka iekavās ([1], [2] uc) esošie numuri ir klikšķi uz šīm studijām.
Ja uzskatāt, ka kāds no mūsu saturiem ir neprecīzs, novecojis vai citādi apšaubāms, lūdzu, atlasiet to un nospiediet Ctrl + Enter.
B hepatīta patogenēzē var identificēt vairākas vadošās saites patogenētiskajā ķēdē:
- patogēna ieviešana - infekcija;
- fiksācija uz hepatocītiem un iekļūšana šūnā;
- vīrusa pavairošana un tā "izspiešana" uz hepatocītu virsmas, kā arī asinīs;
- imunoloģisko reakciju aktivizēšana, kuru mērķis ir iznīcināt patogēnu;
- imūnkompleksa bojājumi orgāniem un sistēmām;
- imunitātes veidošanās, atbrīvošanās no patogēna, atveseļošanās.
Tā kā inficēšanās ar B hepatītu vienmēr notiek parenterāli, var uzskatīt, ka inficēšanās brīdis praktiski ir līdzvērtīgs vīrusa iekļūšanai asinīs. Dažu pētnieku mēģinājumi atšķirt B hepatīta enterālo un reģionālo fāzi ir vāji pamatoti. Ir vairāk pamata uzskatīt, ka vīruss nekavējoties nonāk aknās kopā ar asinsriti.
B hepatīta vīrusa tropismu pret aknu audiem nosaka īpaša receptora klātbūtne HBsAg - polipeptīds ar molekulmasu 31 000 Da (P31), kam piemīt albumīnu saistoša aktivitāte. Līdzīga albumīna zona ir atrodama arī uz hepatocītu membrānas cilvēku un šimpanžu aknās, kas būtībā nosaka HBV tropismu pret cilvēku un šimpanžu aknām.
Kad vīruss iekļūst hepatocītos, tiek atbrīvota vīrusu DNS, kas, nonākot hepatocītu kodolā un darbojoties kā matrica nukleīnskābju sintēzei, izraisa virkni secīgu bioloģisku reakciju, kuru rezultātā notiek vīrusa nukleokapsīda montāža. Nukleokapsīds migrē caur kodola membrānu citoplazmā, kur notiek Dane daļiņu galīgā montāža - pilnīgs B hepatīta vīruss.
Tomēr jāatzīmē, ka, inficējot hepatocītus, process var noritēt divos veidos - replikatīvi un integratīvi. Pirmajā gadījumā attīstās akūta vai hroniska hepatīta aina, bet otrajā - vīrusa nēsāšana.
Iemesli, kas nosaka divu veidu mijiedarbību starp vīrusu DNS un hepatocītiem, nav precīzi noteikti. Visticamāk, atbildes veids ir ģenētiski noteikts.
Replikatīvās mijiedarbības rezultāts ir kodola antigēnu struktūru montāža (kodolā) un pilnīga vīrusa montāža (citoplazmā), kam seko pilnīga vīrusa vai tā antigēnu prezentācija uz membrānas vai hepatocītu membrānas struktūrā.
Ir vispārpieņemts, ka vīrusa replikācija neizraisa šūnu bojājumus hepatocītu līmenī, jo B hepatīta vīrusam nav citopātiskas iedarbības. Šo nostāju nevar uzskatīt par neapstrīdamu, jo tā balstās uz eksperimentāliem datiem, kas, lai gan norāda uz B hepatīta vīrusa citopātiskas iedarbības neesamību, tika iegūti audu kultūrās un tāpēc tos nevar pilnībā ekstrapolēt uz vīrushepatītu B cilvēkiem. Jebkurā gadījumā jautājums par hepatocītu bojājumu neesamību replikācijas fāzē prasa papildu pētījumus.
Tomēr, neatkarīgi no vīrusa mijiedarbības rakstura ar šūnu, aknas obligāti ir iekļautas imunopatoloģiskajā procesā. Šajā gadījumā hepatocītu bojājums ir saistīts ar to, ka vīrusu antigēnu ekspresijas rezultātā uz hepatocītu membrānas un vīrusu antigēnu izdalīšanās brīvā asinsritē rezultātā tiek iekļauta secīgu šūnu un humorālu imūnreakciju ķēde, kuras galvenais mērķis ir vīrusa izvadīšana no organisma. Šis process tiek veikts pilnībā ievērojot vispārējos imūnās atbildes modeļus pret vīrusu infekcijām. Lai iznīcinātu patogēnu, tiek iekļautas šūnu citotoksiskas reakcijas, ko mediē dažādas efektora šūnu klases: K šūnas, T šūnas, dabiskie killeri, makrofāgi. Šo reakciju laikā inficētie hepatocīti tiek iznīcināti, ko pavada vīrusu antigēnu (HBcAg, HBeAg, HBsAg) izdalīšanās, kas iedarbina antivielu ģenēzes sistēmu, kā rezultātā asinīs uzkrājas specifiskas antivielas, galvenokārt pret kodolu - anti-HBc un e-antigēns - anti-HBE. Līdz ar to aknu šūnas atbrīvošanās no vīrusa notiek tās nāves procesā šūnu citolīzes reakciju dēļ.
Vienlaikus specifiskas antivielas, kas uzkrājas asinīs, saistās ar vīrusa antigēniem, veidojot imūnkompleksus, kurus fagocitizē makrofāgi un izdala nieres. Šajā gadījumā var rasties dažādi imūnkompleksu bojājumi glomerulonefrīta, arterīta, artralģijas, ādas izsitumu u.c. veidā. Piedaloties specifiskām antivielām, organisms tiek attīrīts no patogēna un notiek pilnīga atveseļošanās.
Saskaņā ar izklāstīto B hepatīta patogenēzes koncepciju, visu slimības gaitas klīnisko variantu daudzveidību parasti izskaidro vīrusa mijiedarbības un imūnkompetentu šūnu sadarbības īpatnības, citiem vārdiem sakot, imūnās atbildes stiprums pret vīrusu antigēnu klātbūtni. Saskaņā ar mūsdienu koncepcijām imūnās atbildes stiprums ir ģenētiski noteikts un saistīts ar pirmās klases HLA lokusa histokompatibilitātes antigēniem.
Ir vispārpieņemts, ka atbilstošas imūnās atbildes uz vīrusu antigēniem apstākļos akūts hepatīts klīniski attīstās ar ciklisku gaitu un pilnīgu atveseļošanos. Uz vīrusu antigēnu imūnās atbildes samazināšanās fona imūnsistēmas mediētā citolīze ir nenozīmīga, tāpēc nav efektīvas inficēto aknu šūnu eliminācijas, kas noved pie vieglām klīniskām izpausmēm ar ilgstošu vīrusa noturību un, iespējams, hroniska hepatīta attīstību. Tajā pašā laikā, gluži pretēji, ģenētiski noteiktas spēcīgas imūnās atbildes un masīvas infekcijas (hemotransfūzijas) gadījumā rodas plaši aknu šūnu bojājumu apgabali, kas klīniski atbilst smagām un ļaundabīgām slimības formām.
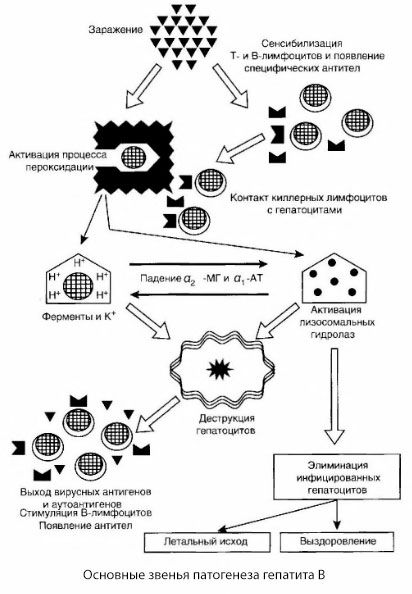
Piedāvātā B hepatīta patogenēzes shēma izceļas ar savu saskaņotību; tomēr tajā ir vairāki pretrunīgi un maz pētīti punkti.
Ja sekojam B hepatīta kā imunopatoloģiskas slimības koncepcijai, mēs varētu sagaidīt šūnu citotoksicitātes reakciju pieaugumu, palielinoties slimības smagumam. Tomēr smagās formās imunitātes šūnu saites rādītāji ir strauji samazināti, tostarp vairākkārtēji samazinājušies, salīdzinot ar veseliem bērniem, un K-šūnu citotoksicitātes indekss. Ļaundabīgā formā, masīvas aknu nekrozes un īpaši aknu komas attīstības periodā, tiek atzīmēta pilnīga limfocītu nespēja veikt blastu transformāciju fitohematlutinīna, stafilokoku endotoksīna un HBsAg ietekmē. Turklāt leikocīti nespēj migrēt atbilstoši leikocītu migrācijas inhibīcijas reakcijai (LMIC), un saskaņā ar pētījumu rezultātiem, izmantojot fluorescējošu tetraciklīna zondi, tiek atklāts straujš limfocītu membrānu caurlaidības pieaugums.
Tādējādi, ja veseliem cilvēkiem limfocītu fluorescences indeksi ir 9,9±2%, un tipiska B hepatīta gadījumā ar labdabīgu gaitu tie palielinās līdz 22,3±2,7%, tad ļaundabīgās formās fluorescējošo limfocītu skaits sasniedz vidēji 63,5±5,8%. Tā kā literatūrā šūnu membrānu caurlaidības palielināšanās nepārprotami tiek vērtēta kā ticams to funkcionālās mazvērtības rādītājs, var secināt, ka B hepatīta gadījumā, īpaši ļaundabīgā formā, ir rupji limfocītu bojājumi. To apliecina arī K šūnu citotoksicitātes indeksi. Smagā formā, slimības 1.–2. nedēļā, citotoksicitāte ir 15,5±8,8%, bet ļaundabīgā formā 1. nedēļā - 6,0±2,6, 2. nedēļā - 22,0±6,3% ar normu 44,8±2,6%.
Iesniegtie dati skaidri norāda uz izteiktiem imunitātes šūnu saiknes traucējumiem pacientiem ar smagām B hepatīta formām. Ir arī acīmredzams, ka šīs izmaiņas rodas sekundāri, imūnkompetentu šūnu bojājumu rezultātā ar toksiskiem metabolītiem un, iespējams, cirkulējošiem imūnkompleksiem.
Kā liecina pētījumi, pacientiem ar smagām B hepatīta formām, īpaši masīvas aknu nekrozes attīstības gadījumā, HBsAg un HBeAg titrs asins serumā samazinās, un vienlaikus sāk parādīties antivielas pret virsmas antigēnu augstos titros, kas ir pilnīgi neraksturīgi labdabīgām slimības formām, kurās anti-HBV parādās tikai slimības 3.-5. mēnesī.
B hepatīta vīrusa antigēnu strauja izzušana ar vienlaicīgu augstu pretvīrusu antivielu titru parādīšanos liecina par intensīvu imūnkompleksu veidošanos un to iespējamo līdzdalību masveida aknu nekrozes attīstības patogenēzē.
Tādējādi faktiskie materiāli neļauj mums viennozīmīgi interpretēt B hepatītu tikai no imunopatoloģiskās agresijas viedokļa. Un būtība ir ne tikai tā, ka nav konstatēta saistība starp aknu morfoloģisko izmaiņu dziļumu un izplatību, no vienas puses, un šūnu imunitātes faktoru smagumu, no otras puses. Teorētiski šo apstākli varētu izskaidrot ar šūnu imunitātes rādītāju izpētes vēlīnajiem posmiem, kad imūnkompetentās šūnas tika pakļautas spēcīgai toksiskai iedarbībai pieaugošās aknu funkcionālās nepietiekamības dēļ. Protams, var pieņemt, ka hepatocītu imūncitolīze notiek infekcijas procesa agrīnākajos posmos, iespējams, pat pirms smagu aknu bojājumu klīnisko simptomu parādīšanās. Tomēr šāds pieņēmums ir maz ticams, jo līdzīgi šūnu imunitātes rādītāji tika konstatēti pacientiem ar visakūtāko (zibens) slimības gaitu, un turklāt aknu audu morfoloģiskās izmeklēšanas laikā netika konstatēta masīva limfocītu infiltrācija, savukārt tajā pašā laikā tika konstatēti nepārtraukti nekrotiska epitēlija lauki bez rezorbcijas un limfocītu agresijas parādībām.
Akūta hepatīta morfoloģisko ainu ir ļoti grūti izskaidrot tikai no imūnšūnu citolīzes viedokļa, tāpēc agrīnajos pētījumos netika izslēgta B hepatīta vīrusa citotoksiskā iedarbība.
Pašlaik šo pieņēmumu daļēji apstiprina B hepatīta vīrusa atklāšana. Kā liecina pētījumi, D hepatīta marķieru noteikšanas biežums ir tieši atkarīgs no slimības smaguma pakāpes: vieglās formās tie tiek atklāti 14%, vidēji smagos gadījumos - 18%, smagos gadījumos - 30% un ļaundabīgos gadījumos - 52% pacientu. Ņemot vērā, ka D hepatīta vīrusam piemīt nekrogēna citopātiska iedarbība, var uzskatīt par pierādītu, ka koinfekcijai ar B un D hepatīta vīrusiem ir liela nozīme B hepatīta fulminantu formu attīstībā.
B hepatīta patoģenēzi var attēlot šādi. Pēc B hepatīta vīrusa iekļūšanas hepatocītos inficētajiem hepatocītiem tiek ierosināta imunoloģiska uzbrukuma T-killeru darbība, kas izdala limfotoksīnus aknu šūnu virzienā.
Hepatīta B gadījumā hepatocītu bojājumu intīmie mehānismi vēl nav noskaidroti. Vadošo lomu spēlē aktivizētie lipīdu peroksidācijas un lizosomu hidrolāžu procesi. Ierosinātājs var būt limfotoksīni, kas izdalās no efektora šūnām, tām nonākot saskarē ar hepatocītiem, bet iespējams, ka pats vīruss var būt peroksidācijas procesu ierosinātājs. Pēc tam patoloģiskais process, visticamāk, attīstās šādā secībā.
- Agresijas faktora (limfotoksīnu vai vīrusa) mijiedarbība ar bioloģiskām makromolekulām (iespējams, ar endoplazmatiskā retikuluma membrānu komponentiem, kas spēj piedalīties detoksikācijas procesos, pēc analoģijas ar citiem kaitīgiem līdzekļiem, kā parādīts attiecībā uz tetrahloroglekli).
- Brīvo radikāļu veidošanās, lipīdu peroksidācijas procesu aktivācija un visu hepatocelulāro membrānu caurlaidības palielināšanās (citolīzes sindroms).
- Bioloģiski aktīvo vielu kustība pa koncentrācijas gradientu - dažādu intracelulāru lokalizāciju enzīmu, enerģijas donoru, kālija u.c. zudums. Nātrija un kalcija uzkrāšanās šūnās, pH maiņa intracelulāras acidozes virzienā.
- Lizosomu hidrolāžu (RNSāzes, DNSāzes, katepsīnu u.c.) aktivācija un atbrīvošanās ar aknu šūnu sadalīšanos un autoantigēnu atbrīvošanu.
- T un B imūnsistēmas stimulēšana, veidojot specifisku T limfocītu sensibilizāciju pret aknu lipoproteīniem, kā arī antihepatisku humorālu autoantivielu veidošanos.
Ierosinātajā B hepatīta patogenēzes shēmā iedarbinošais faktors ir vīrusu antigēni, kuru intensīva ražošana tiek novērota slimības agrīnākajās stadijās un visā akūtā periodā, izņemot ļaundabīgās formas, kurās vīrusu antigēnu ražošana praktiski apstājas masīvas aknu nekrozes attīstības laikā, kas nosaka strauju vīrusu replikācijas samazināšanos.
Ir arī acīmredzams, ka vīrusu antigēni aktivizē imunitātes T un B sistēmas. Šī procesa laikā notiek raksturīga T limfocītu apakšpopulāciju pārdale, kuras mērķis ir organizēt atbilstošu imūnreakciju, likvidēt inficētos hepatocītus, neitralizēt vīrusu antigēnus, veikt sanoģenēzi un atveseļošanos.
Kad imūnkompetentas šūnas mijiedarbojas ar vīrusu antigēniem uz hepatocītu membrānām vai vīrusa reprodukcijas laikā hepatocītu iekšienē, rodas apstākļi lipīdu peroksidācijas procesu aktivizēšanai, kas, kā zināms, kontrolē visu šūnu un subcelulāro membrānu caurlaidību.
No šīs pozīcijas kļūst saprotama citolīzes sindroma rašanās, paaugstināta šūnu membrānu caurlaidība, kas ir tik dabiska un ļoti raksturīga vīrusu hepatītam.
Citolīzes sindroma galīgais iznākums var būt pilnīga oksidatīvās fosforilēšanās atvienošanās, šūnu materiāla noplūde un aknu parenhīmas nāve.
Tomēr lielākajā daļā gadījumu šie procesi neiegūst tik letālu attīstību. Tikai ļaundabīgās slimības formās patoloģiskais process norit lavīnveidīgi un neatgriezeniski, jo rodas masīva infekcija, izteikts imūnprocess, pārmērīga peroksidācijas procesu un lizosomu hidrodāžu aktivācija, kā arī autoimūnas agresijas parādības.
Tie paši mehānismi tiek novēroti labvēlīgā B hepatīta gaitā, ar vienīgo īpatnību, ka tie visi tiek realizēti kvalitatīvi atšķirīgā līmenī. Atšķirībā no masīvas aknu nekrozes gadījumiem, labvēlīgā slimības gaitā inficēto hepatocītu skaits un līdz ar to arī imunopatoloģiskās citolīzes zona ir mazāka, lipīdu peroksidācijas procesi nav tik būtiski pastiprināti, skābju hidrolāžu aktivācija noved tikai pie ierobežotas autolīzes ar nenozīmīgu autoantigēnu izdalīšanos, un tāpēc bez masīvas autoagresijas, tas ir, visi patogenēzes posmi labvēlīgā gaitā tiek veikti saglabātās aknu parenhīmas strukturālās organizācijas ietvaros un tos ierobežo aizsardzības sistēmas (antioksidanti, inhibitori utt.), un tāpēc tiem nav tik destruktīvas ietekmes.
Vīrushepatīta intoksikācijas simptomu cēloņi nav pilnībā izpētīti. Priekšlikumu atšķirt tā saukto primāro jeb vīrusu intoksikāciju no sekundārās (apmaiņas jeb vielmaiņas) var uzskatīt par pozitīvu, lai gan tas neatklāj vispārējā toksiskā sindroma rašanās intīmo mehānismu. Pirmkārt, hepatīta vīrusiem nepiemīt toksiskas īpašības, un, otrkārt, daudzu metabolītu koncentrācija ne vienmēr korelē ar slimības smagumu un toksikozes simptomu izpausmes pakāpi. Ir arī zināms, ka vīrusu antigēnu koncentrācija stingri nekorelē ar intoksikācijas smagumu. Gluži pretēji, palielinoties slimības smagumam un līdz ar to toksikozes pakāpei, HBsAg koncentrācija samazinās un ir viszemākā ļaundabīgās formās dziļas aknu komas sākumā. Tajā pašā laikā specifisko pretvīrusu antivielu noteikšanas biežums un titri tieši atkarīgi no slimības smaguma pakāpes.
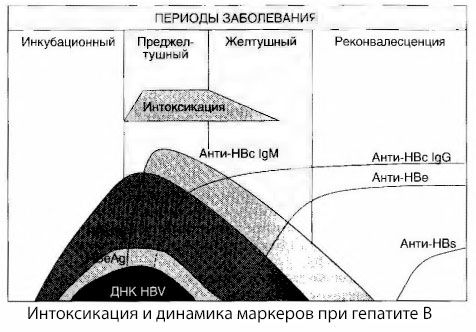
Reibums neparādās vīrusu antigēnu reģistrācijas brīdī, bet gan IgM klases pretvīrusu antivielu cirkulācijas laikā asinīs pret govs antigēnu un E sistēmas antigēnu. Turklāt smagās un īpaši ļaundabīgās formās ievērojamai daļai pacientu asinīs ir pat anti-HB, kas parasti nekad netiek novērots vieglās un vidēji smagas slimības formās.
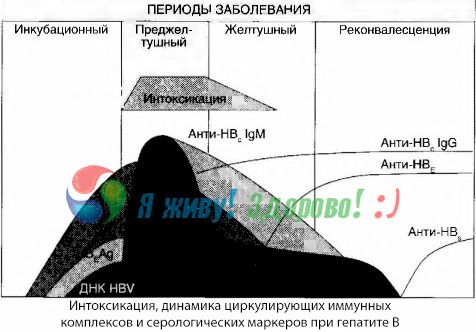
Iesniegtie dati ļauj secināt, ka toksikozes sindroms vīrusu hepatīta, un jo īpaši B hepatīta, gadījumā nerodas vīrusu antigēnu parādīšanās rezultātā asinīs, bet gan ir vīrusu antigēnu mijiedarbības ar IgM klases pretvīrusu antivielām sekas. Šādas mijiedarbības rezultāts, kā zināms, ir imūnkompleksu un, iespējams, aktīvu toksisku vielu veidošanās.
Reibuma simptomi rodas imūnkompleksu parādīšanās brīdī brīvā asinsritē, bet vēlāk šāda korelācija netiek novērota.
Daļēju skaidrojumu tam var atrast imūnkompleksu sastāva pētījumā. Pacientiem ar smagām formām asinīs cirkulē galvenokārt vidēja lieluma kompleksi, un to sastāvā toksiskā sindroma kulminācijas laikā dominē šīs klases antivielas, savukārt klīnisko izpausmju samazināšanās un atveseļošanās periodā kompleksi kļūst lielāki, un to sastāvā sāk dominēt IgG klases antivielas.
Iesniegtie dati attiecas uz toksiskā sindroma attīstības mehānismiem slimības sākumperiodā, bet toksikozē, kas rodas klīnisko izpausmju kulminācijā, tiem ir tikai daļēja nozīme, un jo īpaši aknu komas attīstībā.
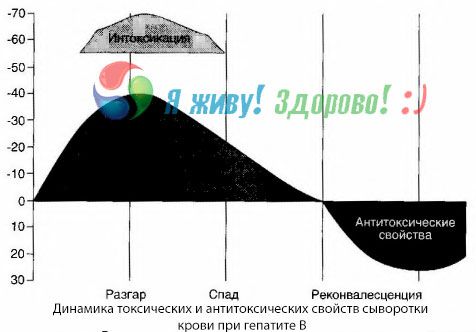
Asins kultūru metode ir parādījusi, ka ar B hepatītu asinīs pastāvīgi uzkrājas toksīni, kas izdalās no bojātajiem, pūšanas procesā esošajiem aknu audiem. Šo toksīnu koncentrācija ir proporcionāla slimības smagumam, tie ir olbaltumvielu rakstura.
Atveseļošanās periodā asinīs parādās antivielas pret šo toksīnu; bet aknu komas gadījumā toksīna koncentrācija asinīs strauji palielinās, un antivielas asinīs netiek konstatētas.
B hepatīta patomorfoloģija
Pamatojoties uz morfoloģisko izmaiņu raksturu, izšķir trīs akūta B hepatīta formas:
- cikliskā forma,
- masīva aknu nekroze;
- holestātisks periholangiolītisks hepatīts.
Cikliskajā B hepatīta formā distrofiskas, iekaisīgas un proliferatīvas izmaiņas ir izteiktākas daivu centrā, savukārt A hepatīta gadījumā tās lokalizējas gar daivu perifēriju, izplatoties uz centru. Šīs atšķirības izskaidrojamas ar dažādiem vīrusa iekļūšanas ceļiem aknu parenhīmā. A hepatīta vīruss iekļūst aknās caur portālo vēnu un izplatās uz daivu centru, B hepatīta vīruss iekļūst caur aknu artēriju un kapilāru zariem, kas vienmērīgi apgādā visas daivas, līdz pat to centram.
Aknu parenhīmas bojājuma pakāpe vairumā gadījumu atbilst slimības klīnisko izpausmju smagumam. Vieglās formās parasti tiek novērota hepatocītu fokālā nekroze, bet vidēji smagās un smagas formās - zonāla nekroze (ar tendenci saplūst un veidot tiltiņainu nekrozi smagās slimības formās).
Vislielākās morfoloģiskās izmaiņas parenhīmā novērojamas klīnisko izpausmju kulminācijā, kas parasti sakrīt ar slimības pirmo desmitgadi. Otrajā un īpaši trešajā desmitgadē pastiprinās reģenerācijas procesi. Šajā periodā nekrobiotiskās izmaiņas gandrīz pilnībā izzūd un sāk dominēt šūnu infiltrācijas procesi, kam seko lēna hepatocelulāro plātnīšu struktūras atjaunošanās. Tomēr pilnīga aknu parenhīmas struktūras un funkcijas atjaunošanās notiek tikai 3–6 mēnešus pēc slimības sākuma un ne visiem pacientiem.
B hepatīta infekcijas vispārināto raksturu apstiprina HBsAg noteikšana ne tikai hepatocītos, bet arī nierēs, plaušās, liesā, aizkuņģa dziedzerī, kaulu smadzeņu šūnās utt.
Holestatiskais (periholangiolītiskais) hepatīts ir īpaša slimības forma, kurā vislielākās morfoloģiskās izmaiņas ir intrahepatisko žultsvadu daļā, ar holangiolīta un periholangiolīta ainu. Holestātiskajā formā holestāze rodas ar žults kapilāru paplašināšanos un žults stāzi tajos, ar holangiolu proliferāciju un šūnu infiltrātiem ap tiem. Šajā hepatīta formā aknu šūnas tiek skartas nenozīmīgi. Klīniski slimībai raksturīga ilgstoša gaita ar ilgstošu dzelti. Ir pierādīts, ka šādas savdabīgas slimības gaitas cēlonis ir vīrusa dominējošā ietekme uz holangiolu sieniņām ar nenozīmīgu ietekmi uz hepatocītiem.

