Raksta medicīnas eksperts
Jaunas publikācijas
Restenoze
Pēdējā pārskatīšana: 23.04.2024

Visi iLive saturs ir medicīniski pārskatīts vai pārbaudīts, lai nodrošinātu pēc iespējas lielāku faktisko precizitāti.
Mums ir stingras iegādes vadlīnijas un tikai saikne ar cienījamiem mediju portāliem, akadēmiskām pētniecības iestādēm un, ja vien iespējams, medicīniski salīdzinošiem pārskatiem. Ņemiet vērā, ka iekavās ([1], [2] uc) esošie numuri ir klikšķi uz šīm studijām.
Ja uzskatāt, ka kāds no mūsu saturiem ir neprecīzs, novecojis vai citādi apšaubāms, lūdzu, atlasiet to un nospiediet Ctrl + Enter.
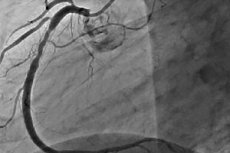
Restenoze ir 50% vai vairāk atkārtotas šaurības izmaiņas perkutānas koronārās intervences vietā. Restenozi parasti piedzīvo stenokardijas recidīvs, kas bieži vien prasa atkārtotas iejaukšanās. Kad PCI attīstījās, restenozes biežums samazinājās, turklāt tā raksturs mainījās.
Restenoze pēc transluminal balonu koronārās angioplastikas (TBA)
Pēc TBA veikšanas, restenozes biežums pirmajos 6 mēnešos. Ir 30-40%. Galvenais mehānisms tās attīstība ir vietējais negatīvs remodeling no kuģa, kas ir, bet faktiski, ir elastīgās spadenie lūmeniem no artērijas, balons paplašināta procedūras laikā. Relatīvā loma ir arī vietējai trombozei un neointimālajai augšanai. Piešķirt klīnisku (2. Tipa cukura diabēts, akūta koronāra sindroma (ACS), restenozes vēsturē), angiogrāfija (LAD bojājumam, mazā diametra kuģi, hroniskas kopējo oklūziju (HTO), ilgu bojājumu, degenerated vēnu potzarus) un ārstēšanas (augstu atlikušo artērijas stenozes, neliels kuģa diametra pieaugums balona inflācijas rezultātā), restenozes riska faktori pēc TBA. Restenozes gadījumā parasti tiek veikta atkārtota iejaukšanās. Atkārtota TBA veiksme restenozes vietā ir salīdzināma ar pirmo procedūru. Tomēr ar katru nākamo TBCA restenozei restenozes atkārtošanās risks ievērojami palielinās. Pēc trešā mēģinājuma tas sasniedz 50-53%. Turklāt, veicot atkārtotu TBA katru reizi, restenozes attīstība ir izteiktāka nekā pirmā. Riska faktori attīstībai restenozes pēc otrā TBCA par restenozes ir agri izskats pirmā restenozes (60-90 dienas pēc procedūras), PNS pieveic mnogososudistos bojājumi, klātbūtne 2. Tipa cukura diabēts, hipertensija, nestabilu stenokardiju, kā arī vairāku inflācijas balons pie pirmās procedūra. Ņemot vērā augsto saslimstību ar restenozes un mehānismu tās attīstības klīniskajā praksē tika ieviesta koronāro stentu, kas teorētiski būtu jālikvidē negatīvi asinsvadu izmaiņas pēc TBCA.
Pirmie pētījumi, kas parādīja stentu lietošanas efektivitāti, tika publicēti 1993. Gadā, pētījums par STRESS un BENESTENT. In BENESTENT tā iekļauti 516 pacienti ar pirmreizēji diagnosticētu stenozi koronāro artēriju, kuru diametrs ir lielāks nekā 3 mm, kas randomizēti sadalīja divās grupās: regulārā TBCA (n = 257) TBCA un stenta (n = 259). Pēc 3 gadiem rezintoze ar angiogrāfiju parastā TBCA grupā bija 32%, bet stentu grupā - 22%. Restenozes sastopamības relatīvais samazinājums bija 31% (p <0,01). In stenting grupā arī bija mazāka ir vajadzība pēc atkārtotas revaskularizācijas miokarda (10 vs 20,6% grupā normālas TBCA, p <0,01), kas bija saistīts ar retākiem atkārtošanās stenokardijas in stenting joslā.
Saskaņā STRESA pētījumi (n = 407), kas stenting grupā (n ~ 205) restenorirovaniya frekvence ir zemāka nekā parasto TBCA grupā (n = 202), - 31,6 vs 42,1% (p <0,01 ) Iespēja izmantot parasto angioplastijas stentu pirms gadījumā restenozes vietā TBCA REST priekšrocība ir pierādīta pētījumā, kurā 383 pacienti ar restenozes randomizēti sadalīja stenting vai re-perkutānas translumināras koronārās angioplastijas. Angiogrāfiski nosakāms restenozes bija par zemāks par 18% no stenta (18 vs 5,32%; p <0.03). Atkārtota miokarda revaskularizāciju, kas ir rādītājs klīniski nozīmīgu restenozes vajadzīgs arī ievērojami mazāk grupā pacientu tika veikta stenta (10 vs 27%, p <0,001). Tādējādi, labākos rezultātus, piemērojot stenta ir pierādīts ne tikai dzimtajā artērijās, bet arī attiecībā uz intervences restenozes attīstās pēc TBCA.
Restenoze pēc neatklātas stenta (NPC) implantācijas
Kaut nepārklāti koronārās stenti ir mazināja restenozes, salīdzinot ar TBCA 30-40%, 17 -32% pacientu, pat pēc stenta restenozi jau izstrādājusi iekšā stents, kas prasa revaskularizāciju. Iekšējās stenozes (HRV) attīstības mehānisms atšķiras no TBA attīstības mehānisma. Pēc stentiņa galveno ieguldījumu restenozē izraisa neointima veidošanās, nevis negatīva remodelēšana, tāpat kā TBA, ko praktiski nav stenta implantācijas vietā. Neointima veido gludās muskulatūras šūnu migrācija un izplatīšanās, kas rada ārpuscelulu matricu, kas kopā ar šūnām veido neointimu. Turklāt diabēta pacientiem ir svarīga arī trombas noturība stenojuma vietā.
Galvenais klasifikāciju-stenta stenoze (HRV) ir klasifikācija ierosinātais MEHRAN, kas ietver četru veidu atkarībā no un smaguma bojājumu: es HRV tips - vietējo (<10 mm garums), II tipa - izkliedēto (> 10 mm garumā), III tips - proliferatīvs (> 10 mm un aiz stenta) un IV tips - HRV, kas izraisa oklūziju. Pirmais veids ir sadalīts apakštipos atkarībā no atrašanās vietas stents: 1a - līkumu vai starp stenta, 1b - malas, 1c - iekšpusē stents, 1.d - daudzfokusu.
Riska faktori attīstībai MII ir intervences pas vēnu potzariem hroniskas oklūziju, grīva bojājumi, neliels kuģis diametrs, klātbūtne atlikušā stenozi, stenting par MII, mazs postprotsedurny kuģis diametra, PNA pārveidošanas, liels garums stents, klātbūtnē diabēta, implantācijas no vairākiem stentiem vienā sakāvi . Ir norādes par ietekmi ģenētisko faktoru, jo īpaši glikoproteīna IIIa polimorfisms un gēnu mutāciju rezultātā methylenetetrahydrofolate reduktāzes - gēnu, kurš kodē interleikīna-1. Gadījumā, ja mala-stenta restenozes ir galvenais riska faktors aterosklerotisko bojājumu izteikta stentiruemom segmentā.
Pārsvarā restenozi rodas pirmajos 6-8 mēnešos. Pēc perkutānas koronārās intervences. Lielākajā daļā pacientu apmēram tajā pašā laikā ir klīniskie simptomi. Parasti HRV izpaužas kā stenokardijas recidīvs. Retāk (11-41% gadījumu) ir nestabila stenokardija. 1-6% pacientu attīstās AMI. Tādējādi visbiežākais stenokardijas cēlonis ir 1-6 mēneši. Pēc stenta ir HRV attīstība, kas parasti prasa atkārtotu revaskularizāciju. Ir vairākas HRV ārstēšanas metodes. Var veikt parasto TBA, kas noved pie stenta atvēršanas (ieguldījums 56% apmērā, lai palielinātu kuģa diametru), kā arī nospiež neointimu caur stentu šūnām (44% lielais ieguldījums gala diametra palielināšanā). Tomēr lielāko daļu intervences vietā novēro atlikušo restenozi (vidēji 18%). Turklāt pēc TBA atkārtotā revaskularizācija ir nepieciešama 11% gadījumu, biežāk pacientiem ar daudzstundu bojājumiem, zemu LVEF, ja notiek iejaukšanās vēnu šuntu gadījumā vai agrīna pirmās VDR iestāšanās. Reproducējošā PVA attīstīšanās risks pēc TBCA arī ir atkarīgs no bojājuma veida un svārstās no 10% lokālās restenozes gadījumā līdz 80% ar invazīvu oklūziju. NPV implantēšana HRV vietā nesamazinās tā atkārtošanās risku salīdzinājumā ar tikai TBA.
Otrā HRV ārstēšanas metode ir brahiterapija, kuras mērķis ir ievadīt koronāro artēriju vēderā radioaktīvo avotu, kas novērš gludās muskulatūras šūnu proliferāciju un attiecīgi samazina restenozes risku. Tomēr augstās iekārtas izmaksas, procedūras tehniskā sarežģītība un vēlīnā stenta trombozes (TC) biežuma samazināšanās gandrīz pilnībā izslēdza brahiterterapiju no klīniskās lietošanas.
Revolucionārs VRS ārstēšanas moments bija zāļu izdalīšanās stentu ieviešana. Salīdzinot ar native VSP, ja tie samazina arteriālo 70-80% risks HRV pirmās datu SLP efektivitāte pacientiem ar jau izstrādāto HRV tika iegūti pacientiem reģistrēt Taxus III, kurā piemērojot SPG1 šiem pacientiem pēc 6 mēnešiem. HRV atkārtošanās biežums bija tikai 16%, kas ir zemāks nekā iepriekš minētajos pētījumos ar TBA. TRUE reģistrā, kurā iekļauti pacienti pēc ATP implantācijas NPC restenozes gadījumā, pēc 9 mēnešiem. Atkārtota revaskularizācija bija nepieciešama mazāk nekā 5% pacientu, galvenokārt ar cukura diabētu un ACS. TROPICAL Pētījumā salīdzināja saslimstību ar restenozes pacientiem pēc implantācijas vietā restenozi DES Data Research GAMMA I un GAMMA II, kurā E kā ārstēšanas metode piemērota Brahiterapijas. Pēc 6 mēnešiem. ATP grupā restenozes biežums bija ievērojami zemāks (9,7 pret 40,3%, p <0,0001). Svarīgi, ka biežums stenta trombozes, miokarda infarkts arī bija zemāks grupā ATP (TS 0,6%, salīdzinot ar 3,9; p = 0.08, MI - 1,8 vs 9,4%; p = 0.004). No ATP iepriekšējas brahiterapijas priekšrocība tika apstiprināts nejaušinātā SISR pētījumā, kurā 384 pacienti ar noteikta HRV ar HPC randomizēti ATP vai Brahiterapijas implantācijas. Pēc 9 mēnešiem. Nepieciešamība pēc atkārtotas revaskularizācijas bija lielāka pēc brahiterapijas (19,2%) nekā grupa implantēta PSI (8.5%), kas atspoguļo biežāk recidīva restenozi. Pēc 3 gadiem turpinājās ATP priekšrocība, samazinot nepieciešamību pēc atkārtotas revaskularizācijas, lai atkārtotu stenta restenozi (19 pret 28,4%). Trombozes sastopamības biežums starp grupām būtiski neatšķiras.
Galvenie faktori atkārtošanās HRV pacientiem ar NPC gadījumā ATP implantācijas ir neliels kuģis diametrs (<2,5 mm), difūza tips restenozes, kā arī klātbūtne hronisku nieru mazspēju, kam nepieciešama dialīze. Randomizētā TAXUS V ISR pētījumā SPP arī pierādīja augstu efektivitāti HRV ārstēšanā, samazinot restenozes atkārtošanās ātrumu par 54% salīdzinājumā ar brahiterapiju.
Tika veikti arī randomizēti pētījumi, salīdzinot TBA efektivitāti attiecībā uz HRV un SLP implantāciju. Randomizētā RIBS-II pētījumā pēc 9 mēnešiem. Pēc SLP implantēšanas atkārtota restenoze bija 72% retāk nekā pēc TBA, kas samazināja nepieciešamību pēc atkārtotas revaskularizācijas ar 30 līdz 11%. ISAR DESIRE pētījumā TBA efektivitāti HRV salīdzināja ar SPP vai ATP implantāciju. Pēc 6 mēnešiem. Izrādījās, ka gan BLT novērstu restenozi efektīvāk nekā TBCA (attīstības temps bija 44,6%, pie TBCA, 14,3% ATP grupā un 21,7% grupā CPR), kas samazināja nepieciešamību pēc atkārtotas revaskularizācijas. PPS un ATP tiešajā salīdzinājumā izrādījās, ka ATP samazina nepieciešamību pēc revaskularizācijas ievērojami efektīvāk nekā PPS (8 pret 19%). Tādējādi, implantācija SLP samazina saslimstību recidīva HRV NPS salīdzinot gan ar TBCA un brahiterapijas, kas samazina skaits retranslāciju nav PKI un implantācijas procedūra izvēles šiem pacientiem.
Restenoze pēc implantācijas ar narkotiku izdalošu stentu (SLP)
Neskatoties uz 70-80% samazinājumu frekvenču-stenta stenozi ar vērā DES pieteikuma salīdzinājumā ar NPC, viņi nevarēja pilnībā izslēgt attīstību jatrogēnām ietekmi stenta. Tās kopējā biežuma vērtība vidēji ir mazāka par 10%. Papildus kvantitatīvai restenozes sastopamības samazināšanai tie arī būtiski izmainīja veidojošo restenozes tipu. Tātad, pēc SLP implantācijas, restenoze, kā likums, ir centrāla. Klīniski, tāpat kā NPS gadījumā, tas visbiežāk izpaužas kā stabilas stenokardijas recidīvs (77%), retāk (8%) tā ir asimptomātiska. 5% gadījumu tas izpaužas kā nestabila stenokardija, un 10% - pirmais simptoms ir bez Q-miokarda infarkts. Galvenie restenozes SLP veidošanās faktori ir 2. Tipa cukura diabēts, neliels traumas diametrs, kā arī bojājuma apmērs. Nav skaidru ieteikumu par šādu pacientu vadību. Alternatīvas ir atkārtota SLP (tā paša tipa vai cita tipa) implantēšana, TBA vadīšana vai brahiterapija. Vidējā restenozes attīstības biežums otrajā SLP implantēšanā ir 24%, bet tā ir tāda pati gadījumā, ja implantē vienu un to pašu SLP veidu vai citu.


 [
[