Jaunas publikācijas
Slēgta zāļu piegādes sistēma var uzlabot ķīmijterapijas piegādi
Pēdējā pārskatīšana: 02.07.2025

Visi iLive saturs ir medicīniski pārskatīts vai pārbaudīts, lai nodrošinātu pēc iespējas lielāku faktisko precizitāti.
Mums ir stingras iegādes vadlīnijas un tikai saikne ar cienījamiem mediju portāliem, akadēmiskām pētniecības iestādēm un, ja vien iespējams, medicīniski salīdzinošiem pārskatiem. Ņemiet vērā, ka iekavās ([1], [2] uc) esošie numuri ir klikšķi uz šīm studijām.
Ja uzskatāt, ka kāds no mūsu saturiem ir neprecīzs, novecojis vai citādi apšaubāms, lūdzu, atlasiet to un nospiediet Ctrl + Enter.
Kad vēža pacientiem tiek veikta ķīmijterapija, vairuma zāļu devas tiek aprēķinātas, pamatojoties uz pacienta ķermeņa virsmas laukumu. To aprēķina, izmantojot vienādojumu, kurā ņemts vērā pacienta augums un svars. Šis vienādojums tika formulēts 1916. gadā, pamatojoties uz datiem par tikai deviņiem pacientiem.
Šī vienkāršotā dozēšanas pieeja neņem vērā citus faktorus un var novest pie tā, ka pacientam tiek ievadīts pārāk daudz vai pārāk maz zāļu. Tā rezultātā dažiem pacientiem var rasties nevajadzīga toksicitāte vai nepietiekama ķīmijterapijas efektivitāte.
Lai uzlabotu ķīmijterapijas dozēšanas precizitāti, MIT inženieri ir izstrādājuši alternatīvu pieeju, kas ļauj personalizēt devu katram pacientam. Viņu sistēma mēra zāļu daudzumu pacienta organismā un nodod šos datus kontrolierim, kas var attiecīgi pielāgot infūzijas ātrumu.
Šī pieeja varētu palīdzēt kompensēt zāļu farmakokinētikas atšķirības, ko izraisa ķermeņa sastāvs, ģenētiskā predispozīcija, ķīmijterapijas izraisīta orgānu toksicitāte, mijiedarbība ar citām zālēm un pārtiku, kā arī diennakts ritma variācijas fermentos, kas ir atbildīgi par ķīmijterapijas zāļu sadalīšanos, norāda pētnieki.
"Atzīstot sasniegumus zāļu metabolisma izpratnē un pielietojot inženiertehniskos rīkus, lai vienkāršotu personalizētu dozēšanu, mēs uzskatām, ka varam palīdzēt pārveidot daudzu zāļu drošību un efektivitāti," sacīja Džovanni Traverso, MIT mašīnbūves asociētais profesors, Brighamas un sieviešu slimnīcas gastroenterologs un pētījuma vecākais autors.
Luiss DeRiders, MIT maģistrants, ir žurnālā Med publicētā raksta vadošais autors.
Nepārtraukta uzraudzība
Šajā pētījumā pētnieki koncentrējās uz zālēm, ko sauc par 5-fluoruracilu, ko lieto kolorektālā vēža un citu vēža veidu ārstēšanai. Zāles parasti ievada 46 stundu laikā, un to devu nosaka, izmantojot formulu, kas balstīta uz pacienta augumu un svaru, kas sniedz ķermeņa virsmas laukuma aplēsi.
Tomēr šī pieeja neņem vērā ķermeņa sastāva atšķirības, kas var ietekmēt zāļu izplatīšanos organismā, vai ģenētiskās variācijas, kas ietekmē to metabolizāciju. Šīs atšķirības var izraisīt kaitīgas blakusparādības, ja tiek ievadīts pārāk daudz zāļu. Ja netiek ievadīts pietiekami daudz zāļu, tās var neiznīcināt audzēju, kā paredzēts.
"Cilvēkiem ar vienādu ķermeņa virsmas laukumu var būt ļoti atšķirīgs augums un svars, atšķirīga muskuļu masa vai atšķirīga ģenētika, taču, ja vien šajā vienādojumā iekļautais augums un svars dod vienādu ķermeņa virsmas laukumu, viņu deva ir identiska," saka DeRidders, doktora grāda kandidāts medicīnas inženierzinātņu un medicīniskās fizikas programmā Hārvardas-MIT Veselības zinātņu un tehnoloģiju programmā.
Vēl viens faktors, kas jebkurā laikā var mainīt zāļu daudzumu asinīs, ir diennakts ritma svārstības enzīmā, ko sauc par dihidropirimidīna dehidrogenāzi (DPD), kas noārda 5-fluoruracilu. DPD ekspresiju, tāpat kā daudzus citus organisma enzīmus, regulē diennakts ritms. Tādējādi 5-FU noārdīšanās ar DPD nav nemainīga, bet mainās atkarībā no diennakts laika. Šie diennakts ritmi infūzijas laikā var izraisīt desmitkārtīgas 5-FU daudzuma svārstības pacienta asinīs.
"Izmantojot ķermeņa virsmas laukumu, lai aprēķinātu ķīmijterapijas devu, mēs zinām, ka diviem cilvēkiem var būt ļoti atšķirīga 5-fluoruracila toksicitāte. Vienam pacientam var būt ārstēšanas cikli ar minimālu toksicitāti, bet pēc tam cikls ar briesmīgu toksicitāti. Kaut kas ir mainījies veidā, kā pacients metabolizēja ķīmijterapiju no viena cikla uz nākamo. Mūsu novecojusī dozēšanas metode šīs izmaiņas neatspoguļo, un pacienti cieš," saka Duglass Rubinsons, klīniskais onkologs Dana-Farber vēža institūtā un raksta autors.
Viens no veidiem, kā kompensēt ķīmijterapijas farmakokinētikas mainīgumu, ir stratēģija, ko sauc par terapeitisko zāļu monitoringu, kurā pacients viena ārstēšanas cikla beigās nodod asins paraugu. Pēc tam, kad šajā paraugā ir veikta zāļu koncentrācijas analīze, devu var pielāgot, ja nepieciešams, nākamā cikla sākumā (parasti divas nedēļas 5-fluoruracila gadījumā).
Ir pierādīts, ka šī pieeja nodrošina labākus rezultātus pacientiem, taču tā nav plaši izmantota ķīmijterapijām, piemēram, 5-fluoruracilam.
MIT pētnieki vēlējās izstrādāt līdzīgu uzraudzības veidu, bet automatizētā veidā, kas ļautu personalizēt zāļu devu reāllaikā, kas varētu uzlabot pacientu rezultātus.
To slēgtās cilpas sistēmā zāļu koncentrāciju var nepārtraukti uzraudzīt, un šī informācija tiek izmantota, lai automātiski pielāgotu ķīmijterapijas zāļu infūzijas ātrumu, lai deva paliktu mērķa diapazonā.
Šī slēgtā cikla sistēma ļauj personalizēt zāļu devu, ņemot vērā zāļu metabolizējošo enzīmu līmeņa diennakts ritmus, kā arī jebkādas izmaiņas pacienta farmakokinētikā kopš pēdējās ārstēšanas reizes, piemēram, ķīmijterapijas izraisītu orgānu toksicitāti.
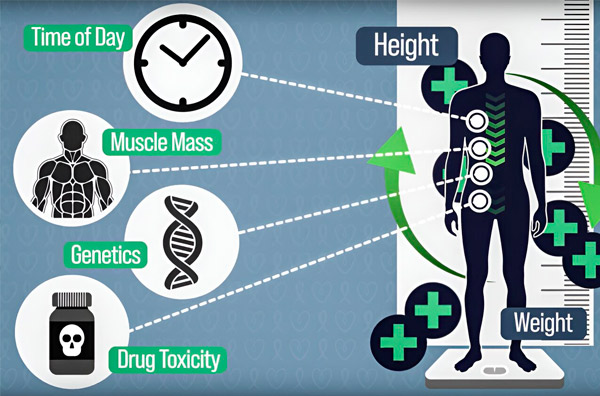
Lai ķīmijterapijas dozēšanu padarītu precīzāku, MIT inženieri ir izstrādājuši veidu, kā nepārtraukti mērīt zāļu daudzumu pacienta organismā vairāku stundu ilgas infūzijas laikā. Tas palīdzēs kompensēt atšķirības, ko izraisa ķermeņa sastāvs, ģenētika, zāļu toksicitāte un diennakts ritma svārstības. Avots: Ar pētnieku atļauju.
Pētnieku izstrādātā jaunā sistēma, kas pazīstama kā CLAUDIA (Closed-Loop AUtomated Drug Infusion regulAtor — slēgtas cilpas automatizēts zāļu infūzijas regulators), katram solim izmanto komerciāli pieejamu aprīkojumu. Asins paraugi tiek ņemti ik pēc piecām minūtēm un ātri sagatavoti analīzei. Tiek mērīta 5-fluoruracila koncentrācija asinīs un salīdzināta ar mērķa diapazonu.
Starpība starp mērķa un izmērītajām koncentrācijām tiek ievadīta vadības algoritmā, kas pēc tam nepieciešamības gadījumā pielāgo infūzijas ātrumu, lai uzturētu devu koncentrāciju diapazonā, kurā zāles ir efektīvas un netoksiskas.
"Mēs esam izstrādājuši sistēmu, kurā mēs varam nepārtraukti mērīt zāļu koncentrāciju un attiecīgi pielāgot infūzijas ātrumu, lai uzturētu zāļu koncentrāciju terapeitiskajā logā," saka DeRidder.
Ātra regulēšana
Dzīvnieku testos pētnieki atklāja, ka, lietojot CLAUDIA, viņi varēja uzturēt organismā cirkulējošās zāles daudzumu mērķa diapazonā aptuveni 45% laika.
Dzīvniekiem, kuriem tika veikta ķīmijterapija bez CLAUDIA, zāļu līmenis mērķa diapazonā saglabājās vidēji tikai 13% laika. Šajā pētījumā pētnieki nepārbaudīja zāļu līmeņa efektivitāti, taču tiek uzskatīts, ka koncentrācijas uzturēšana mērķa logā nodrošina labākus rezultātus un mazāku toksicitāti.
CLAUDIA arī spēja uzturēt 5-fluoruracila devu mērķa diapazonā pat tad, ja tika ievadītas zāles, kas inhibē DPD enzīmu. Dzīvniekiem, kuriem šis inhibitors tika ievadīts bez nepārtrauktas uzraudzības un devas pielāgošanas, 5-fluoruracila līmenis palielinājās pat astoņas reizes.
Šajā demonstrācijā pētnieki manuāli veica katru procesa soli, izmantojot standarta aprīkojumu, bet tagad plāno automatizēt katru soli, lai uzraudzību un devas pielāgošanu varētu veikt bez cilvēka iejaukšanās.
Lai mērītu zāļu koncentrācijas, pētnieki izmantoja augstas veiktspējas šķidruma hromatogrāfijas-masas spektrometrijas (HPLC-MS) metodi, ko var pielāgot gandrīz jebkura veida zāļu noteikšanai.
"Mēs redzam nākotni, kurā mēs varēsim izmantot CLAUDIA jebkurām zālēm, kurām ir atbilstošas farmakokinētiskās īpašības un kuras var noteikt ar HPLC-MS, ļaujot personalizēt devu daudzām dažādām zālēm," saka DeRidders.
