Jaunas publikācijas
ARID1A gēnu mutācija padara audzējus jutīgus pret imūnterapiju
Pēdējā pārskatīšana: 14.06.2024

Visi iLive saturs ir medicīniski pārskatīts vai pārbaudīts, lai nodrošinātu pēc iespējas lielāku faktisko precizitāti.
Mums ir stingras iegādes vadlīnijas un tikai saikne ar cienījamiem mediju portāliem, akadēmiskām pētniecības iestādēm un, ja vien iespējams, medicīniski salīdzinošiem pārskatiem. Ņemiet vērā, ka iekavās ([1], [2] uc) esošie numuri ir klikšķi uz šīm studijām.
Ja uzskatāt, ka kāds no mūsu saturiem ir neprecīzs, novecojis vai citādi apšaubāms, lūdzu, atlasiet to un nospiediet Ctrl + Enter.
Imunoterapija pēdējos gados ir mainījusi vēža ārstēšanu. Tā vietā, lai tieši vērstos pret audzējiem, imūnterapija virza pacientu imūnsistēmu, lai efektīvāk uzbruktu audzējiem. Tas ir īpaši efektīvs dažiem grūti ārstējamiem vēža veidiem. Tomēr mazāk nekā puse no visiem vēža slimniekiem reaģē uz pašreizējām imūnterapijām, radot steidzamu nepieciešamību noteikt biomarķierus, kas varētu paredzēt, kuri pacienti, visticamāk, gūs labumu no ārstēšanas.
Nesen zinātnieki pamanīja, ka pacientiem, kuru audzējos ir ARID1A gēna mutācija, ir lielāka iespēja pozitīvi reaģēt uz imūnās kontrolpunkta blokādi, kas ir efektīvas imūnterapijas veids. Saglabājot aktivizētas imūnās šūnas, kas cīnās pret vēzi.
Tā kā ARID1A gēna mutācija ir sastopama daudzos vēža veidos, tostarp endometrija, olnīcu, kolorektālā, kuņģa, aknu un aizkuņģa dziedzera vēža gadījumā, Solka institūta pētnieki domāja, kā tā varētu veicināt ārstēšanas jutību un kā ārsti varētu izmantot šo informāciju, lai personalizētu vēzi. Ārstēšana katram pacientam.
Viņu jaunais pētījums, kas publicēts žurnālā žurnāls Cell, liecina, ka ARID1A mutācija padara audzējus jutīgus pret imūnterapiju, iesaistot audzēja imūnās šūnas, kas cīnās pret vēzi, izmantojot imūnreakciju.. Līdzīgi pretvīrusu līdzekļiem.
Pētnieki ierosina, ka šo mutāciju un pretvīrusu imūnreakciju varētu izmantot kā biomarķieri, lai labāk atlasītu pacientus specifiskām imūnterapijām, piemēram, imūnās kontrolpunkta blokādei. Šie rezultāti arī veicina tādu zāļu izstrādi, kuru mērķis ir ARID1A un ar to saistītie proteīni, lai padarītu citus audzējus jutīgākus pret imūnterapiju.
"Tas patiešām varētu mainīt vēža ārstēšanas rezultātus pacientiem," saka asociētā profesore Diāna Hargrīvza, pētījuma vecākā autore. "Pacientiem ar ARID1A mutāciju jau ir imūnā atbilde, tāpēc viss, kas mums jādara, ir jāpastiprina šī reakcija ar imūnās kontrolpunkta blokādi, lai palīdzētu viņiem iznīcināt audzējus no iekšpuses."
Lai gan bija zināms, ka cilvēki ar ARID1A mutācijām labi reaģēja uz imūnās kontrolpunkta blokādi, precīza saistība starp abiem palika neskaidra. Lai noskaidrotu šī procesa mehānismu, Solkas institūta zinātnieki izmantoja melanomas un kolorektālā vēža peles modeļus ar ARID1A mutāciju un funkcionālu ARID1A.
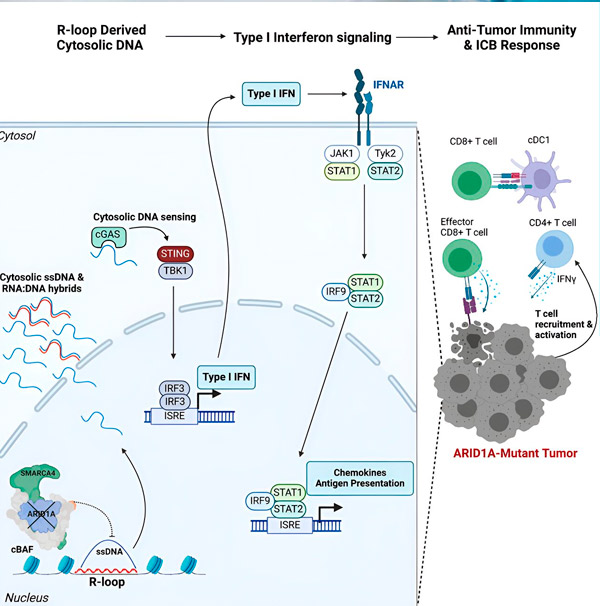
Avots: Cell (2024). DOI: 10.1016/j.cell.2024.04.025
Komanda novēroja spēcīgu imūnreakciju visos modeļos ar ARID1A mutāciju, bet ne tajos, kuros ARID1A darbojās, tādējādi apstiprinot domu, ka ARID1A mutācija patiešām veicina šo reakciju. Bet kā tas darbojas molekulārā līmenī?
“Mēs noskaidrojām, ka ARID1A ir svarīga loma kodolā, uzturot pareizu DNS organizāciju,” saka Metjū Maksvels, pētījuma pirmais autors un Hārgrīvsas laboratorijas maģistrants. "Bez funkcionāla ARID1A brīvo DNS var izgriezt un izdalīt citozolā, kas aktivizē vēlamo pretvīrusu imūnreakciju, ko var pastiprināt imūnās kontrolpunkta blokāde."
ARID1A gēns kodē proteīnu, kas palīdz regulēt mūsu DNS formu un uzturēt genoma stabilitāti. Kad ARID1A mutē, vēža šūnās tiek aktivizēta notikumu ķēde, kas līdzīga Rube Goldberg iekārtai.
Sākotnēji funkcionāla ARID1A neesamība izraisa DNS izdalīšanos citozolā. Pēc tam citozola DNS aktivizē pretvīrusu trauksmes sistēmu, cGAS-STING ceļu, jo mūsu šūnas ir pielāgotas, lai atzīmētu jebkuru citozolā esošo DNS kā svešu, lai aizsargātu pret vīrusu infekcijām. Galu galā cGAS-STING ceļš piesaista imūnsistēmu, lai piesaistītu T šūnas audzējam un aktivizē tās specializētās vēža slepkavas T šūnās.
Katrā solī, atkarībā no iepriekšējā, šī notikumu ķēde — ARID1A mutācija, DNS aizbēgšana, cGAS-STING brīdinājums, T šūnu piesaiste — izraisa ar vēzi apkarojošo T šūnu skaita pieaugumu audzējā. Pēc tam imūnās kontrolpunkta blokādi var izmantot, lai nodrošinātu, ka šīs T šūnas paliek aktivizētas, uzlabojot to spēju uzveikt vēzi.
"Mūsu atklājumi nodrošina jaunu molekulāru mehānismu, ar kura palīdzību ARID1A mutācija var veicināt pretvēža imūnreakciju," saka Hārgrīvs. "Visaizraujošākais šajos rezultātos ir to translācijas potenciāls. Mēs varam izmantot ARID1A mutācijas, lai atlasītu pacientus imūnās kontrolpunkta blokādei, un tagad mēs redzam mehānismu, ar kura palīdzību zāles, kas inhibē ARID1A vai tā proteīnu kompleksu, varētu izmantot, lai vēl vairāk uzlabotu imūnterapiju. Citiem pacientiem."
Aprakstot mehānismu, ar kuru imūnās kontrolpunkta blokāde ir efektīvāka vēža gadījumā ar ARID1A mutāciju, pētnieki sniedz pamatojumu ārstiem, lai šīs imūnterapijas prioritāte būtu pacientiem ar ARID1A mutāciju. Šie rezultāti ir nozīmīgs solis vēža ārstēšanas personalizācijā un iedvesmo jaunu terapiju izstrādi, kuru mērķis ir inhibēt ARID1A un tā proteīnu kompleksu.
Nākotnē Solka institūta komanda cer, ka viņu atklājumi uzlabos rezultātus pacientiem ar dažādiem vēža veidiem, kas saistīti ar ARID1A mutācijām, un plāno izpētīt šo klīnisko tulkojumu sadarbībā ar Kalifornijas Universitāti Sandjego. p>
