Jaunas publikācijas
Jauni ģenētiskie mehānismi var nodrošināt terapeitiskus mērķus pret gliomu
Pēdējā pārskatīšana: 14.06.2024

Visi iLive saturs ir medicīniski pārskatīts vai pārbaudīts, lai nodrošinātu pēc iespējas lielāku faktisko precizitāti.
Mums ir stingras iegādes vadlīnijas un tikai saikne ar cienījamiem mediju portāliem, akadēmiskām pētniecības iestādēm un, ja vien iespējams, medicīniski salīdzinošiem pārskatiem. Ņemiet vērā, ka iekavās ([1], [2] uc) esošie numuri ir klikšķi uz šīm studijām.
Ja uzskatāt, ka kāds no mūsu saturiem ir neprecīzs, novecojis vai citādi apšaubāms, lūdzu, atlasiet to un nospiediet Ctrl + Enter.
Pētījumi no Ši-Juana Čena (Shi-Yuan Cheng), PhD, Neiroloģijas katedras Neiro-onkoloģijas nodaļas profesora Kena un Rutas Deivija laboratorijas, ir identificējuši jaunus mehānismus, kas ir pamatā alternatīviem RNS splicēšanas notikumiem gliomas audzēja šūnās, kas var kalpot jauni terapeitiskie mērķi. Pētījuma rezultāti ir publicēti Journal of Clinical Investigation.
"Mēs atradām citu veidu, kā ārstēt gliomu, izmantojot alternatīvas savienošanas lēcas, un atklājām jaunus mērķus, kas iepriekš nebija identificēti, bet ir svarīgi gliomas ļaundabīgo audzēju gadījumā. Teica Xiao Song, MD, PhD, neiroloģijas asociētais profesors un pētījuma galvenais autors.
Gliomas ir visizplatītākais primārā smadzeņu audzēja veids pieaugušajiem un rodas no glia šūnām, kas atrodas centrālajā nervu sistēmā un atbalsta tuvumā esošos neironus. Gliomas ir ļoti izturīgas pret standarta ārstēšanu, tostarp starojumu un ķīmijterapiju, jo audzēja ģenētiskā un epiģenētiskā neviendabība liecina, ka ir jāatrod jauni terapeitiskie mērķi.
Iepriekšējie Cheng laboratorijas pētījumi, kas publicēti žurnālā Cancer Research, parādīja, ka svarīgais savienošanās faktors SRSF3 gliomās ir ievērojami paaugstināts salīdzinājumā ar normālām smadzenēm, un SRSF3 regulēts. RNS splicēšana veicina gliomas augšanu un progresēšanu, ietekmējot vairākus šūnu procesus audzēja šūnās.
RNS splicēšana ir process, kas ietver intronu (RNS nekodējošo reģionu) noņemšanu un eksonu (kodējošos reģionu) savienošanu, veidojot nobriedušu mRNS molekulu, kas atbalsta gēnu ekspresiju šūnā.
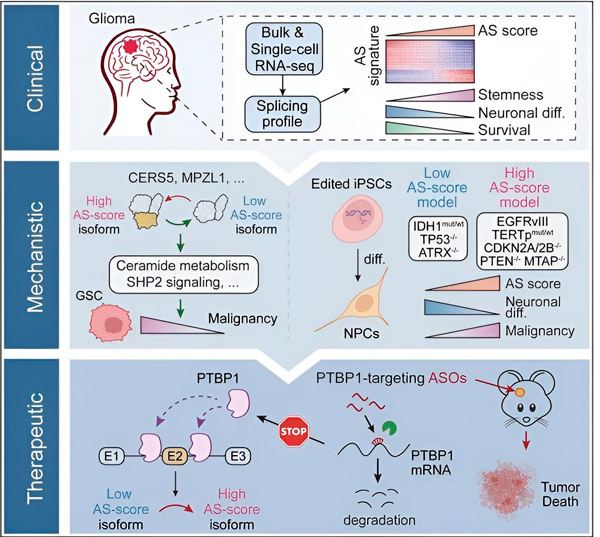
Šajā pētījumā zinātnieki izvirzīja mērķi noteikt gliomas audzēja šūnu alternatīvās savienošanas izmaiņas, mehānismus, kas ir šo izmaiņu pamatā, un noteikt to potenciālu kā terapeitiskus mērķus.
Izmantojot skaitļošanas metodes un RNS sekvencēšanas tehnoloģijas, pētnieki pētīja gliomas audzēja šūnu splicēšanas izmaiņas no pacientu paraugiem. Lai apstiprinātu šīs izmaiņas, viņi izmantoja CRISPR gēnu rediģēšanas tehnoloģijas, lai ieviestu dažādas gliomas draiveru mutācijas cilvēka izraisītu pluripotentu cilmes šūnu (iPSC) gliomu modeļos.
Viņi atklāja, ka šīs splicēšanas izmaiņas pastiprina epidermas augšanas faktora receptora III (EGFRIII) variants, kas, kā zināms, ir pārmērīgi ekspresēts daudzos audzējos, tostarp gliomās, un to kavē IDH1 gēna mutācija. p>
Pētnieki apstiprināja divu RNS splicēšanas notikumu funkciju, kas rada dažādas olbaltumvielu izoformas ar atšķirīgām aminoskābju sekvencēm.
"Tikai viena no šīm izoformām var veicināt audzēja augšanu, pretstatā otrai izoformai, kas parasti izpaužas normālās smadzenēs. Audzēji izmanto šo mehānismu, lai selektīvi ekspresētu audzēju veicinošo izoformu pār parasto smadzeņu izoformu," Song teica.
Pēc tam komanda analizēja RNS saistošos proteīnus un atklāja, ka PTBP1 gēns regulē audzēju veicinošās RNS splicēšanu gliomas šūnās. Izmantojot gliomas ortotopisku imūndeficīta peles modeli, pētnieki mērķēja uz PTBP1 ar antisense oligonukleotīdu (ASO) terapiju, kas galu galā nomāca audzēja augšanu.
"Mūsu dati izceļ alternatīvas RNS splicēšanas lomu gliomas ļaundabīgo audzēju un neviendabīguma ietekmēšanā un tās potenciālu kā terapeitisku ievainojamību pieaugušo gliomu ārstēšanā," raksta pētījuma autori.
Pētnieki turpmāk plāno izpētīt potenciālu mērķēt uz PTBP1, lai izraisītu pretaudzēju imūnreakciju, sacīja Songs.
"Izmantojot ilgi lasītu RNS-seq analīzi, mēs atklājām, ka, mērķējot uz PTBP1 gliomas šūnās, rodas daudzi alternatīvi savienoti transkripti, kuru nav normālos audos. Tāpēc mūsu nākamais projekts ir noskaidrot, vai šī izoforma var radīt dažus antigēnus." lai imūnsistēma varētu labāk atpazīt audzēju," sacīja Song.
Dziesma arī piebilda, ka viņas komanda ir ieinteresēta gliomas pacientu šūnās, kas nav audzēji, piemēram, imūnās šūnās, analizēt splicēšanas izmaiņas.
"Mēs jau zinām, ka splicēšana ir ļoti svarīga, lai regulētu funkcijas šūnā, tāpēc tai vajadzētu ne tikai regulēt audzēja ļaundabīgo audzēju, bet arī regulēt imūno šūnu darbību, lai noteiktu, vai tās var efektīvi iznīcināt vēzi. Veicot dažas bioinformātikas analīzes audzēja infiltrētās imūnās šūnās, lai noskaidrotu, vai pēc imūnās šūnas infiltrācijas audzējā ir notikušas izmaiņas splicēšanā.
"Mūsu mērķis ir noteikt alternatīvas savienošanas lomu imūnsupresīvās audzēja mikrovides veidošanā un identificēt iespējamos mērķus, lai uzlabotu gliomas imūnterapijas efektivitāti," sacīja Songs.
