Jaunas publikācijas
FDA apstiprināts TIVDAK®: mērķtiecīga audu faktora iedarbība dzemdes kakla vēža gadījumā
Pēdējā pārskatīšana: 02.07.2025

Visi iLive saturs ir medicīniski pārskatīts vai pārbaudīts, lai nodrošinātu pēc iespējas lielāku faktisko precizitāti.
Mums ir stingras iegādes vadlīnijas un tikai saikne ar cienījamiem mediju portāliem, akadēmiskām pētniecības iestādēm un, ja vien iespējams, medicīniski salīdzinošiem pārskatiem. Ņemiet vērā, ka iekavās ([1], [2] uc) esošie numuri ir klikšķi uz šīm studijām.
Ja uzskatāt, ka kāds no mūsu saturiem ir neprecīzs, novecojis vai citādi apšaubāms, lūdzu, atlasiet to un nospiediet Ctrl + Enter.
2024. gada 29. aprīlī ASV Pārtikas un zāļu pārvalde (FDA) piešķīra pilnīgu apstiprinājumu Seagen Inc. medikamentam TIVDAK® (tisotumaba vedotīns), kas ir pret audu faktoru (TF) vērsta zāle, pacientu ar recidivējošu vai metastātisku dzemdes kakla vēzi ārstēšanai, kas progresējis ķīmijterapijas laikā vai pēc tās. Tas ir nozīmīgs sasniegums dzemdes kakla vēža terapijā, izceļot antivielu zāļu konjugātu (ADC) potenciālu onkoloģijā.
TIVDAK darbības mehānisms
Tivdak ir ADC, kas iedarbojas uz TF, apvienojot Genmab anti-TF monoklonālo antivielu tisotumabu ar Seagen ADC tehnoloģiju, kas paredzēta, lai mērķtiecīgi iedarbotos uz TF antigēniem uz vēža šūnām un piegādātu citotoksisko komponentu MMAE tieši vēža šūnām.
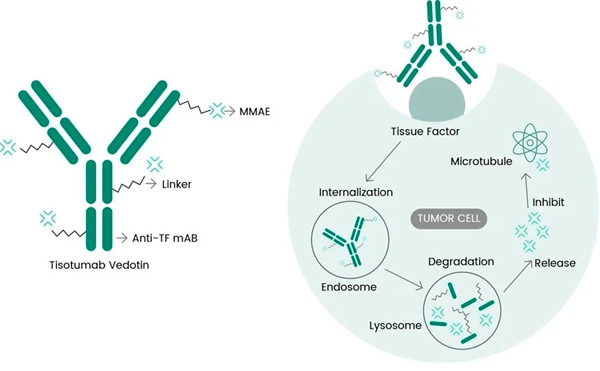
Tisotumaba vedotīna molekulārais darbības mehānisms ( https://doi.org/10.3390/ijms23073559 )
TF: ideāls mērķis ADC izstrādei
Ir zināms, ka TF ir iesaistīts audzēja signalizācijā un angioģenēzē, un tā pārmērīgi ekspresējas lielākajā daļā pacientu ar dzemdes kakla vēzi un daudziem citiem cietajiem audzējiem. Tā spēja ātri internalizēties pēc antivielu saistīšanās un minimālā ietekme uz normālu asins recēšanu vēl vairāk palielina tā piemērotību mērķtiecīgai vēža terapijai.
