Jaunas publikācijas
Pētnieki identificē mutācijas, kas aizsargā pret B šūnu vēzi
Pēdējā pārskatīšana: 02.07.2025

Visi iLive saturs ir medicīniski pārskatīts vai pārbaudīts, lai nodrošinātu pēc iespējas lielāku faktisko precizitāti.
Mums ir stingras iegādes vadlīnijas un tikai saikne ar cienījamiem mediju portāliem, akadēmiskām pētniecības iestādēm un, ja vien iespējams, medicīniski salīdzinošiem pārskatiem. Ņemiet vērā, ka iekavās ([1], [2] uc) esošie numuri ir klikšķi uz šīm studijām.
Ja uzskatāt, ka kāds no mūsu saturiem ir neprecīzs, novecojis vai citādi apšaubāms, lūdzu, atlasiet to un nospiediet Ctrl + Enter.
Teksasas Universitātes Dienvidrietumu medicīnas centra pētnieki spēja nomākt leikēmiju un limfomu peles modelī, kas ģenētiski bija predisponēts šiem vēža veidiem, pilnībā vai daļēji noplicinot olbaltumvielu, ko sauc par midnolīnu, B šūnās.
Viņu atklājumi, kas publicēti žurnālā "Eksperimentālās medicīnas žurnāls", varētu novest pie jaunām šo slimību ārstēšanas metodēm, kas ļauj izvairīties no pašreizējo terapiju nopietnām blakusparādībām.
"Mēs izmantojām tīri ģenētisku pieeju, lai atrastu zāļu mērķi, un šis mērķis bija sensacionāls, jo B šūnu leikēmijas un limfomas ir ļoti atkarīgas no tā, savukārt lielākā daļa saimniekorganismu audu nav," sacīja pētījuma vadītājs Brūss Beitlers, medicīnas doktors, Ģenētiskās saimniekorganismu aizsardzības centra direktors un Teksasas Universitātes Dienvidrietumu medicīnas centra imunoloģijas un iekšējās medicīnas profesors.
Dr. Beitlers, kurš 2011. gadā ieguva Nobela prēmiju fizioloģijā vai medicīnā par svarīgas patogēnu sensoru grupas, kas pazīstama kā Toll līdzīgie receptori, atklāšanu, kas atrodami imūnās šūnās, jau sen ir izmantojis mutaģenēzi — mutāciju ieviešanu dzīvnieku modeļu gēnos, pakļaujot tos ķīmiskai vielai N-etil-N-nitrozourīnvielai (ENU) — kā galveno instrumentu gēnu funkcijas pētīšanai.
Nesen Beutlera laboratorija izstrādāja metodi, kas pazīstama kā automatizēta meiotiskā kartēšana (AMM), kas izseko mutantu peļu neparastās iezīmes līdz cēloņsakarībām, tādējādi identificējot gēnus, kas nepieciešami normāla fizioloģiskā stāvokļa uzturēšanai.
Mutaģenēze bieži izraisa ģenētiskas slimības dzīvniekiem, sniedzot ieskatu skarto gēnu funkcijā, pētot dzīvnieku anomālijas. Tomēr, kā paskaidroja Dr. Beutlers, mutācijas var arī aizsargāt pret slimībām.
Piemēri ir mutācijas, kas aizsargā cilvēkus ar HIV vai iedzimtu sirpjveida šūnu anēmiju no simptomu rašanās. Dažu aizsargājošu mutāciju pamatā esošie mehānismi ir iedvesmojuši zāļu izstrādi dažādu slimību ārstēšanai.
Meklējot aizsargājošas mutācijas imūnsistēmas traucējumu gadījumā, pētnieki pārbaudīja mutantu peles, meklējot imūnās šūnas ar neparastām iezīmēm. Vairākās dzīvnieku grupās ar neparasti zemu B šūnu skaitu — svarīgu adaptīvās imūnsistēmas sastāvdaļu, kas atbild par antivielu ražošanu — pētnieki izmantoja AMM, lai izsekotu deficīta mutācijām midnolīnā, proteīnā, kas galvenokārt atrodams B šūnās.
Lai gan dzīvnieki, kuriem pilnībā trūkst midnolīna, attīstības laikā pirms dzimšanas mirst, vieglākas mutācijas, tostarp dažas, kas ieviestas, izmantojot ģenētiskas metodes, kas ļauj gēnu dzēst pieaugušā vecumā, nerada acīmredzamu kaitējumu.
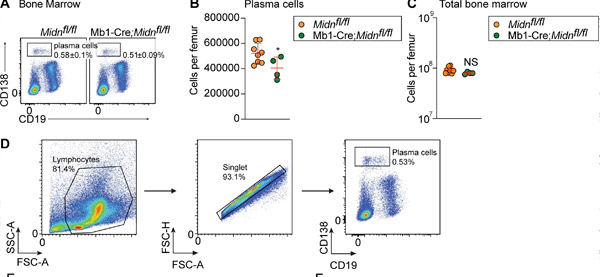
Plazmas šūnu produkcija pēc imunizācijas ar TD antigēna β-galaktozidāzi Mb1-Cre;Midn fl/fl pelēm. (A un B) Reprezentatīvi plūsmas citometrijas grafiki (A) un plazmas šūnu skaits (B) 8 nedēļas vecu Mb1-Cre;Midn fl/fl un Midn fl/fl peļu kaulu smadzenēs pēc imunizācijas ar β-galaktozidāzi. (C) Kopējais kaulu smadzeņu šūnu skaits uz vienu augšstilba kaulu. (D) Plazmas šūnu izolēšanas stratēģija. Avots: Journal of Experimental Medicine (2024). DOI: 10.1084/jem.20232132
Pētnieki ievērojami samazināja vai pilnībā izvadīja midnolīna līmeni pelēm, kurām bija ģenētiska predispozīcija uz B šūnu leikēmiju un limfomu — vēža veidiem, kuros B šūnas nekontrolējami dalās. Lai gan peles ar normālu midnolīna līmeni nomira no šīm slimībām līdz 5 mēnešiem, lielākajai daļai to, kurām midnolīna līmenis bija zemāks vai nebija, nekad neattīstījās ļaundabīgi audzēji.
Papildu eksperimenti parādīja, ka midnolīna loma B šūnās ir stimulēt proteasomu, šūnu organellu, kas atbrīvojas no bojātiem vai vairs nevajadzīgiem proteīniem, aktivitāti. Dažas terapijas, ko pašlaik izmanto B šūnu leikēmijas un limfomas ārstēšanai, darbojas, nomācot proteasomu aktivitāti, līdzīgi kā midnolīna izņemšana, paskaidroja Dr. Beutlers.
Tomēr atšķirībā no šīm zālēm, kurām ir daudz potenciāli nopietnu blakusparādību, midnolīna eliminācijai vai samazināšanai dzīvnieku modeļos nebija nekādas negatīvas ietekmes.
Turpmākie pētījumi būs vērsti uz tādu zāļu izstrādi, kas inhibē midnolīnu, kas galu galā varētu veidot pamatu jaunām B šūnu vēža ārstēšanas metodēm.
