Jaunas publikācijas
LM11A-31 zāles pētījumā palēnina Alcheimera slimības progresēšanu
Pēdējā pārskatīšana: 02.07.2025

Visi iLive saturs ir medicīniski pārskatīts vai pārbaudīts, lai nodrošinātu pēc iespējas lielāku faktisko precizitāti.
Mums ir stingras iegādes vadlīnijas un tikai saikne ar cienījamiem mediju portāliem, akadēmiskām pētniecības iestādēm un, ja vien iespējams, medicīniski salīdzinošiem pārskatiem. Ņemiet vērā, ka iekavās ([1], [2] uc) esošie numuri ir klikšķi uz šīm studijām.
Ja uzskatāt, ka kāds no mūsu saturiem ir neprecīzs, novecojis vai citādi apšaubāms, lūdzu, atlasiet to un nospiediet Ctrl + Enter.

Nesenā pētījumā, kas publicēts žurnālā Nature Medicine, zinātnieki veica randomizētu, dubultmaskētu, placebo kontrolētu 2.a fāzes pētījumu, lai pārbaudītu LM11A-31 drošību un efektivitāti Alcheimera slimības (AS) ārstēšanā, modulējot p75 neirotrofīna receptoru (p75NTR).
Vēlīna AD ir visizplatītākā demences forma, kam raksturīga sinaptiskā mazspēja, deģenerācija un nervu šūnu zudums. Lai gan divas galvenās zāles AD ārstēšanai ir vērstas pret patoloģisku amiloīda-β vai tau proteīnu uzkrāšanos, tās ietekmē tikai daļu no patofizioloģijas. Cita pieeja ietver receptoru un signalizācijas tīklu mērķtiecīgu iejaukšanos, kas ietekmē fundamentālus bioloģiskos ceļus. Preklīniskie pētījumi liecina, ka p75NTR modulācija ar jaunu mazu ķīmisku molekulu LM11A-31 samazina amiloīda un patoloģiska tau izraisīto sinaptisko zudumu.
Pētījuma apraksts
Šajā randomizētajā klīniskajā pētījumā pētnieki pārbaudīja, vai LM11A-31 varētu palēnināt Alcheimera slimības progresēšanu, modulējot p75NTR cilvēkiem.
Pētījuma dalībniekiem 26 nedēļas tika dotas LM11A-31 iekšķīgi lietojamas kapsulas 200 mg un 400 mg devās vai placebo attiecībā 1:1:1 242 pacientiem ar vieglu vai vidēji smagu astmu. Dalībniekiem bija bioloģiski apstiprināta Alcheimera slimība (cerebrospinālā šķidruma amiloīda β proteīna 42 (Aβ42) līmenis zem 550 ng/l vai Aβ42:β40 attiecība zem 0,89), kas diagnosticēta saskaņā ar Makkana kritērijiem, ar Mini-Psihiatriskās izmeklēšanas (MMSE) punktu skaitu no 18 līdz 26, Geriatriskās depresijas skalas (GDS) punktu skaitu zem 5,0, modificētās Hačinska išēmiskās skalas (HIS) punktu skaitu ≤ 4,0, formālo izglītību ≥ 8 gadus un iepriekšēju kognitīvo spēju pasliktināšanos ≥ 6 mēnešus.
Atbilstošie dalībnieki pirms dalības pētījumā ≥ 3 mēnešus bija lietojuši acetilholīnesterāzes inhibitorus (AChEI) vai daļējus NMDA receptoru antagonistus. Viņi nelietoja nelegālas narkotikas, piemēram, antipsihotiskos līdzekļus, benzodiazepīnus, pretkrampju līdzekļus, sedatīvus līdzekļus, centrāli aktīvus antihipertenzīvus līdzekļus, nootropus līdzekļus (izņemot ginkgo biloba) vai opioīdus saturošus pretsāpju līdzekļus.
Pētījuma primārais iznākums bija drošība un panesamība, kas tika novērtēta, izmantojot Kolumbijas pašnāvniecisko domu un uzvedības smaguma pakāpes vērtēšanas skalu (C-SSRS), dzīvības pazīmes, asinsspiedienu un hematoloģiskos parametrus. Sekundāro kognitīvo iznākumu novērtēšanai tika izmantota strukturālā magnētiskās rezonanses attēlveidošana (cMRI), fluorodeoksiglikozes pozitronu emisijas tomogrāfija (FDG-PET) un cerebrospinālā šķidruma (CSF) biomarķieri. AD rādītāji ietvēra Thr181-fosforilēto tau, kopējo tau proteīnu, Aβ40, Aβ42 un AChE aktivitāti. Komanda izmantoja pielāgotu neiropsiholoģisko testu, lai novērtētu sekundāros kognitīvos iznākumus sākotnēji, 12. un 26. nedēļā.
Pētījuma rezultāti
Pētījumā tika konstatēts, ka LM11A-31 ir drošs un labi panesams, bez būtiskām bažām par drošību. Visbiežāk novērotās blakusparādības bija galvassāpes, caureja, eozinofilija un nazofaringīts, un galvenie pārtraukšanas iemesli bija kuņģa-zarnu trakta problēmas un eozinofilija. 400 mg grupā bija vairāk pārtraukšanas gadījumu salīdzinājumā ar 200 mg un placebo grupām. MRI neatklāja nekādas bažas par drošību, tostarp ar amiloīdu saistītas anomālijas. Starp abām ārstēšanas grupām nebija būtisku atšķirību kognitīvajos rādītājos vai amiloīda anomālijās.
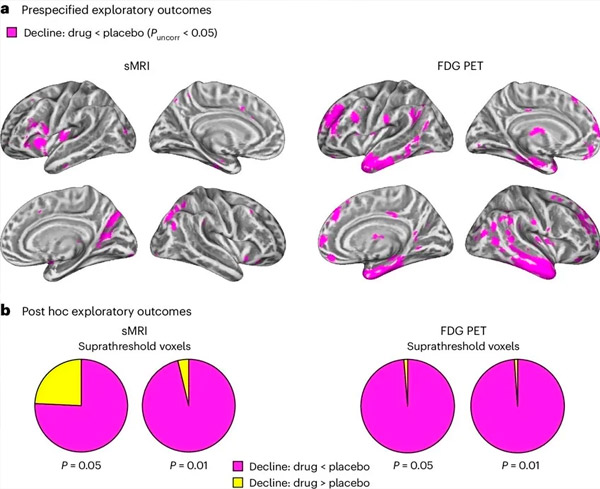
A. Divvirzienu jaukto modeļu kovariācijas analīze pārbaudīja mijiedarbību starp ārstēšanu (zāles vai placebo) un laiku (pirms vai pēc ārstēšanas). Vienpusējs t-kontrasts, pārbaudot mijiedarbības hipotēzi (zāles palēnina progresēšanu salīdzinājumā ar placebo), parādīja, ka LM11A-31 terapija palēnināja garenisko deģenerāciju (kreisās puses paneļi) un glikozes hipometabolismu (labās puses paneļi) zāļu grupā (cMRI, n = 127; PET, n = 121), salīdzinot ar placebo grupu (cMRI, n = 66; PET, n = 62). Vokseļus, kas parāda šo mijiedarbību, attēlo nekoriģētā slieksnī P < 0,05 (fuksīna krāsā) uz populācijai specifiskas kortikālās virsmas. Kreisā un labā puslode ir attēlota attiecīgi augšējā un apakšējā rindā. Smadzeņu reģioni, kas attēlo mijiedarbību, kas neatbilst hipotēzei, ir parādīti 7. attēlā Papildu datos.
B. Kopējais vokseļu skaits iepriekš definētos neaizsargātos AD smadzeņu reģionos (sektordiagrammu kopējais laukums), kas parāda vai nu hipotēzei atbilstošu mijiedarbību (fuksīna krāsā), vai mijiedarbību, kas neatbilst hipotēzei (dzeltenā krāsā) katrā attēlveidošanas modalitātē (cMRI, kreisajā panelī; FDG PET, labajā panelī) ar arvien liberālākiem nekoriģētiem sliekšņiem P < 0,01 un P < 0,05. Montekarlo simulācijas parādīja, ka vokseļu, kas parāda hipotēzei atbilstošu un tai neatbilstošu ietekmi, attiecība bija ievērojami augstāka nekā tā, kas novērota, pamatojoties uz nejauši ģenerētiem datiem gan cMRI, gan PET (P < 0,001 katrai modalitātei; divpusējs tests).
LM11A-31 efektīvi samazināja Aβ42 un Aβ40 līmeņa paaugstināšanos cerebrospinālajā šķidrumā (CSF), salīdzinot ar placebo grupu. Zāles arī uzrādīja presinaptiskā proteīna biomarķiera SNAP25 vidējās gada procentuālās izmaiņas samazināšanos un postsinaptiskā biomarķiera NG samazināšanos, kas norāda uz presinaptisko un postsinaptisko savienojumu zuduma palēnināšanos. LM11A-31 arī samazināja YKL40 līmeņa paaugstināšanos, izraisot MMSE punktu skaita samazināšanos un ADAS-Cog-13 punktu skaita palielināšanos. Zāles arī samazināja pelēkās vielas zudumu frontālajā daivā un aizmugurējā parietālajā garozā, kā arī glikozes metabolisma samazināšanos tādās zonās kā entorinālā garoza, temporālā garoza, hipokamps, salu garoza un prefrontālā garoza.
Secinājums
Pētījumā secināts, ka p75NTR modulācija ar LM11A-31 ir piemērota plašākiem klīniskajiem pētījumiem. LM11A-31 atbilda primārajam drošības kritērijam un bija labi panesams pacientiem ar vieglu līdz smagu AD. Rezultāti liecina par nepieciešamību veikt turpmākus pētījumus ar ilgāku ārstēšanas ilgumu, lai novērtētu mazo molekulu potenciālu regulēt p75NTR kā slimību modificējošu terapiju AD gadījumā. Pētījums parādīja, ka LM11A-31 būtiski ietekmēja vairākus biomarķierus, tostarp Aβ40, Aβ42, SNAP25, NG un YKL40, norādot uz patoloģiskās progresēšanas palēnināšanos. Turpmākajos pētījumos varētu tikt izvērtēti papildu gliju veselības rādītāji.
