Jaunas publikācijas
Noskaidrots galvenais proteīns, kas novērš kaulu masas zudumu osteoporozes gadījumā
Pēdējā pārskatīšana: 02.07.2025

Visi iLive saturs ir medicīniski pārskatīts vai pārbaudīts, lai nodrošinātu pēc iespējas lielāku faktisko precizitāti.
Mums ir stingras iegādes vadlīnijas un tikai saikne ar cienījamiem mediju portāliem, akadēmiskām pētniecības iestādēm un, ja vien iespējams, medicīniski salīdzinošiem pārskatiem. Ņemiet vērā, ka iekavās ([1], [2] uc) esošie numuri ir klikšķi uz šīm studijām.
Ja uzskatāt, ka kāds no mūsu saturiem ir neprecīzs, novecojis vai citādi apšaubāms, lūdzu, atlasiet to un nospiediet Ctrl + Enter.
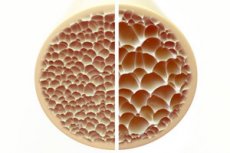
Osteoporoze, stāvoklis, kam raksturīgi poraini un trausli kauli, rada ievērojamus draudus skeleta veselībai. Kauli kā cilvēka ķermeņa galvenais strukturālais balsts nodrošina svarīgu atbalstu. Kad kaulu masa samazinās, tas ne tikai pasliktina šo atbalstu, bet arī pasliktina vispārējo funkciju, kā rezultātā pasliktinās dzīves kvalitāte.
Tā kā osteoporozes sastopamība novecojošā sabiedrībā pieaug, pieaug slodze uz veselības aprūpes resursiem ilgtermiņa aprūpei. Tāpēc ir nepieciešams izprast mehānismus, kas veicina osteoporozes attīstību, un izstrādāt efektīvas mērķtiecīgas ārstēšanas metodes, lai mazinātu tās ilgtermiņa ietekmi.
Osteoblasti un osteoklasti ir divu veidu šūnas, kurām ir galvenā loma kaulu audu uzturēšanā un pārveidošanā. Lai gan osteoblasti ir kaulus veidojošās šūnas, kas atbild par jaunu kaulu audu sintēzi un nogulsnēšanos, osteoklasti ir kaulus noārdošas šūnas, kas iesaistītas vecu vai bojātu kaulu audu sadalīšanā un noņemšanā.
Osteoklastu īpatsvara palielināšanās izraisa kaulu zudumu tādos stāvokļos kā osteoporoze, reimatoīdais artrīts (locītavu iekaisums) un kaulu metastāzes (vēzis, kas izplatījies kaulos). Osteoklasti rodas no makrofāgu jeb monocītu, kas ir imūnšūnu veidi, diferenciācijas.
Tādējādi osteoklastu diferenciācijas inhibīcija varētu kalpot kā terapeitiska stratēģija kaulu zuduma novēršanai. Tomēr precīzi molekulārie mehānismi, kas regulē sarežģīto kaulu remodelācijas procesu, joprojām nav skaidri.
Jaunā pētījumā profesors Tadajoši Hajata, Takuto Konno kungs un Hitomi Murači kundze no Tokijas Zinātņu universitātes kopā ar kolēģiem iedziļinājās osteoklastu diferenciācijas molekulārajā regulācijā. Stimulācija ar kodolfaktora kappa B liganda (RANKL) receptoru aktivatoru izraisa makrofāgu diferenciāciju osteoklastos.
Turklāt RANKL mediētās osteoklastu diferenciācijas regulēšanā ir iesaistīti kaulu morfogēniskā proteīna (BMP) un transformējošā augšanas faktora (TGF)-β signālceļi. Pašreizējā pētījumā pētnieku mērķis bija izpētīt Ctdnep1, fosfatāzes (enzīma, kas noņem fosfātu grupas), lomu, par kuru ziņots, ka tas nomāc BMP un TGF-β signālceļus.
Pētījums ir publicēts žurnālā Biochemical and Biophysical Research Communications.
Profesors Hajata apgalvo: "RANKL darbojas kā osteoklastu diferenciācijas "paātrinātājs". Automašīnas vadīšanai ir nepieciešams ne tikai akselerators, bet arī bremzes. Šeit mēs atklājām, ka Ctdnep1 darbojas kā "bremze" osteoklastu diferenciācijā."
Pētnieki vispirms pārbaudīja Ctdnep1 ekspresiju ar RANKL apstrādātās peļu makrofāgās un neapstrādātās kontroles šūnās. Viņi novēroja, ka Ctdnep1 ekspresija nemainījās, reaģējot uz RANKL stimulāciju. Tomēr makrofāgos tā lokalizējās citoplazmā granulētā veidā un diferencējās osteoklastos, atšķirībā no tās normālās perinukleārās lokalizācijas citos šūnu tipos, norādot uz tās citoplazmatisko funkciju osteoklastu diferenciācijā.
Turklāt Ctdnep1 nomākšana (gēnu ekspresijas samazināšana) izraisīja osteoklastu skaita palielināšanos, kuriem bija pozitīva tartrāta rezistenta skābes fosfatāze (TRAP), kur TRAP ir diferencētu osteoklastu marķieris.
Ctdnep1 izslēgšana izraisīja galveno diferenciācijas marķieru, tostarp "Nfatc1", galvenā transkripcijas faktora, ko inducē RANKL osteoklastu diferenciācijai, pastiprinātu ekspresiju. Šie rezultāti apstiprina Ctdnep1 "bremzēšanas funkciju", ar kuru tas negatīvi regulē osteoklastu diferenciāciju. Turklāt Ctdnep1 izslēgšana izraisīja arī palielinātu kalcija fosfāta absorbciju, kas liecina par Ctdnep1 nomācošo lomu kaulu rezorbcijā.
Visbeidzot, lai gan Ctdnep1 izslēgšana nemainīja BMP un TGF-β signalizāciju, Ctdnep1 deficīta šūnās tika novērots paaugstināts fosforilēto (aktivēto) proteīnu līmenis, kas ir RANKL signalizācijas ceļa produkti. Šie rezultāti liecina, ka Ctdnep1 inhibējošā iedarbība uz osteoklastu diferenciāciju, iespējams, netiek mediēta ar BMP un TGF-β signalizāciju, bet gan ar RANKL signalizācijas ceļa un Nfatc1 proteīnu līmeņa pazemināšanos.
Kopumā šie rezultāti sniedz jaunu ieskatu osteoklastu diferenciācijas procesā un identificē potenciālos terapeitiskos mērķus, kurus varētu izmantot, lai izstrādātu ārstēšanas metodes, kas samazina kaulu zudumu osteoklastu pārmērīgas aktivitātes dēļ. Papildus slimībām, kurām raksturīgs kaulu zudums, Ctdnep1 ir identificēts arī kā cēlonisks faktors medulloblastomā, bērnu smadzeņu audzējā. Autori ir optimistiski noskaņoti, ka viņu pētījumus var paplašināt uz citām cilvēku slimībām, kas nav saistītas ar kaulu metabolismu.
Profesors Hajata secina: "Mūsu rezultāti liecina, ka Ctdnep1 ir nepieciešams, lai novērstu pārmērīgu osteoklastoģenēzi. Šie rezultāti var vēl vairāk paplašināt mūsu zināšanas par to, kā fosforilēšanas-defosforilēšanas tīkls kontrolē osteoklastu diferenciāciju, un var sniegt jaunas terapeitiskās stratēģijas kaulu slimību ārstēšanai, kas saistītas ar pārmērīgu osteoklastu aktivitāti."
