Jaunas publikācijas
Zinātnieki ir radījuši "hameleona" savienojumu, lai ārstētu pret zālēm rezistentu smadzeņu vēzi.
Pēdējā pārskatīšana: 02.07.2025

Visi iLive saturs ir medicīniski pārskatīts vai pārbaudīts, lai nodrošinātu pēc iespējas lielāku faktisko precizitāti.
Mums ir stingras iegādes vadlīnijas un tikai saikne ar cienījamiem mediju portāliem, akadēmiskām pētniecības iestādēm un, ja vien iespējams, medicīniski salīdzinošiem pārskatiem. Ņemiet vērā, ka iekavās ([1], [2] uc) esošie numuri ir klikšķi uz šīm studijām.
Ja uzskatāt, ka kāds no mūsu saturiem ir neprecīzs, novecojis vai citādi apšaubāms, lūdzu, atlasiet to un nospiediet Ctrl + Enter.
Jēlas universitātes zinātnieku jaunā pētījumā aprakstīts, kā jauns ķīmisks savienojums uzbrūk zāļu rezistentiem smadzeņu audzējiem, nekaitējot apkārtējiem veseliem audiem.
Pētījums, kas publicēts Amerikas Ķīmijas biedrības žurnālā, ir svarīgs solis tā saukto "hameleona savienojumu" izstrādē, kurus varētu izmantot cīņai pret dažādiem bīstamiem vēža veidiem.
Gliomas attīstās aptuveni 6,6 gadījumiem uz 100 000 cilvēkiem katru gadu un 2,94 gadījumiem uz 100 000 cilvēkiem līdz 14 gadu vecumam. Izņemot metastāzes no citiem vēža veidiem, kas sasniedz centrālo nervu sistēmu, gliomas veido 26% no visiem smadzeņu audzējiem (primārie smadzeņu audzēji) un 81% no visiem ļaundabīgajiem smadzeņu audzējiem.
Gadu desmitiem pacienti ar glioblastomu ir ārstēti ar zālēm, ko sauc par temozolomīdu. Tomēr lielākajai daļai pacientu rezistence pret temozolomīdu attīstās gada laikā. Piecu gadu izdzīvošanas rādītājs pacientiem ar glioblastomu ir mazāks par 5%.
2022. gadā Jeilas Universitātes ķīmiķis Sets Herzons un staru onkologs Dr. Randžits Bindra izstrādāja jaunu stratēģiju glioblastomu efektīvākai ārstēšanai. Viņi izveidoja pretvēža molekulu klasi, ko sauc par hameleona savienojumiem, kas izmanto DNS atjaunošanas proteīna, kas pazīstams kā O6-metilguanīna DNS metiltransferāze (MGMT), defektu.
Daudzām vēža šūnām, tostarp glioblastomām, trūkst MGMT proteīna. Jauni hameleona savienojumi ir izstrādāti, lai bojātu DNS audzēja šūnās, kurām trūkst MGMT.
Hameleonu savienojumi ierosina DNS bojājumus, nogulsnējot uz DNS primārus bojājumus, kas laika gaitā attīstās par ļoti toksiskiem sekundāriem bojājumiem, kas pazīstami kā starpdzīslu šķērssaites. MGMT aizsargā veselo audu DNS, atjaunojot primāros bojājumus, pirms tie var attīstīties par nāvējošām starpdzīslu šķērssaitēm.
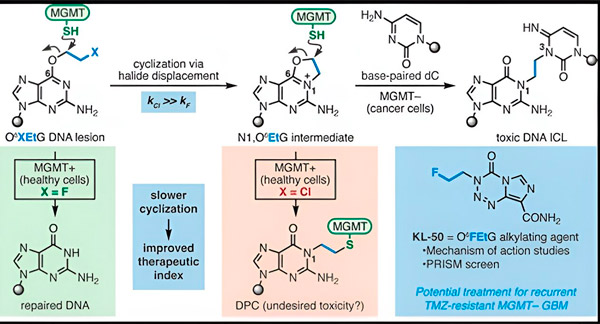
Savā jaunajā pētījumā līdzautori Herzons un Bindra koncentrējās uz savu vadošo hameleonu KL-50.
"Mēs izmantojām sintētiskās ķīmijas un molekulārās bioloģijas pētījumu kombināciju, lai noskaidrotu mūsu iepriekšējo novērojumu molekulāro pamatu, kā arī ķīmisko kinētiku, kas nodrošina šo savienojumu unikālo selektivitāti," sacīja Herzons, Miltona Harisa ķīmijas profesors Jeilas universitātē. "Mēs parādām, ka KL-50 ir unikāls ar to, ka tas veido DNS šķērssaites tikai audzējos ar defektīvu DNS labošanu. Tas saudzē veselos audus."
Avots: Amerikas Ķīmijas biedrības žurnāls (2024). DOI: 10.1021/jacs.3c06483
Tā ir būtiska atšķirība, norāda pētnieki. Vairāki citi pretvēža savienojumi ir izstrādāti, lai ierosinātu starpšķiedru šķērssaites, taču tie nav selektīvi pret audzēja šūnām, ierobežojot to lietderību.
Pētnieki atzīmēja, ka KL-50 panākumu noslēpums ir tā laika noteikšana. KL-50 veido starpšķiedru šķērssaites lēnāk nekā citi šķērssaites veidojošie vielai. Šī aizkavēšanās dod veselām šūnām pietiekami daudz laika, lai izmantotu MGMT, lai novērstu šķērssaišu veidošanos.
"Šis unikālais profils liecina par tā potenciālu pret zālēm rezistentas glioblastomas ārstēšanā, kas ir joma ar lielu neapmierinātu vajadzību klīnikā," sacīja Bindra, Hārvija un Keitas Kušingu terapeitiskās radioloģijas profesors Jeilas Medicīnas skolā. Bindra ir arī Smilo slimnīcas Čenevertu ģimenes smadzeņu audzēju centra zinātniskais direktors.
Herzons un Bindra teica, ka viņu pētījums uzsver, cik svarīgi ir ņemt vērā ķīmiskās DNS modifikācijas un bioķīmiskās DNS atjaunošanas ātrumu. Viņi uzskata, ka var izmantot šo stratēģiju, lai izstrādātu ārstēšanas metodes citiem vēža veidiem, kuriem ir specifiski ar audzēju saistīti DNS atjaunošanas defekti.
